-
化学与人类生产、生活密切相关,下列说法正确的是
A. 铝及其合金是生活中广泛使用的材料,通常用电解氯化铝的方法制取
B. 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量
C. 偏二甲肼[NH2N(CH3)2]是一种液体燃料,它的一种同分异构体可以是氨基酸
D. 邻苯二甲酸二辛酯常用作增塑剂,对人体无害,可用作食品添加剂
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. CH2F2的电子式:
B. CH2=CH—CH2=CH2的系统命名为:1,3—二丁烯
C. 制漂白粉的化学原理:2Cl2 + 2Ca(OH) 2 === CaCl2 + Ca(ClO)2 + 2H2O
D. 制备氢氧化铁胶体:Fe3++3H2O
Fe(OH)3↓+3H+
难度: 简单查看答案及解析
-
下列实验装置(加热装置已略去)或操作合理的是
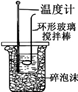
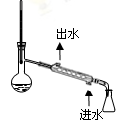
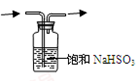
A.吸收氨气
B.中和热的测定
C.分离溴苯和苯的混合物
D.除去SO2气体中的HCl
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 12g石墨烯(
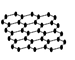 )中含有C—C键的数目为1.5NA
)中含有C—C键的数目为1.5NAB. 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA
C. 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA
D. 在KClO3+6HCl(浓) === KCl+ 3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大, X的质子数为1,Y的最外层电子数是内层电子数的2倍,Z的原子序数等于X和Y的原子序数之和,W 在自然界中既有游离态又有化合态,Q是短周期中原子半径最大的元素。下列叙述正确的是
A. Y4X10分子中,极性键和非极性键的个数比为10:4
B. Z和W形成的多种化合物中只有一种能与水反应
C. 25℃时,Z、W、X按原子个数比2:3:4形成的化合物的水溶液的pH=7
D. 25℃时,等浓度的Z和Q的最高价氧化物对应水化物的水溶液中,水电离的c(H+)相等
难度: 中等查看答案及解析
-
一定温度下,在三个体积均为1 L的恒容密闭容器中发生如下反应:A(g)+2B2(g)
C(g)
其中容器Ⅰ中的反应在5 min时达平衡。
容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
A(g)
B2(g)
C(g)
C(g)
Ⅰ
500
0.5
1.0
0
0.4
Ⅱ
500
a
b
0.25
0.4
Ⅲ
600
0.25
0.5
0.25
0.35
下列说法不正确的是
A. 容器Ⅰ中的反应在前5 min的平均反应速率v(A)=0.08 mol·L-1·min-1
B. 该反应的正反应为放热反应
C. 容器Ⅱ中起始时a=0.25,b=0.5
D. 若起始时向容器Ⅰ中加入A 0.8 mol、B2 1.6 mol,达到平衡时A的转化率为80%
难度: 中等查看答案及解析
-
环丙叉环丙烷(A)结构特殊,根据如下转化判断下列说法正确的是

A. 反应①是加成反应 B. A的所有原子都在一个平面内
C. 反应②是消去反应 D. A的二氯代物只有2种
难度: 中等查看答案及解析

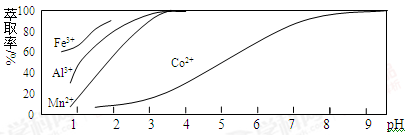
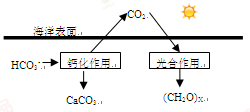


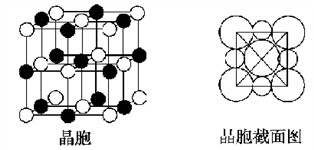
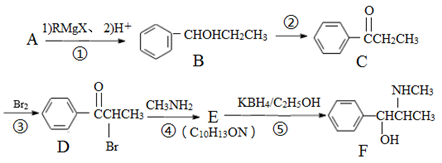
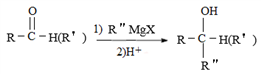 (R、R'、R"均代表烃基;X代表卤素原子);
(R、R'、R"均代表烃基;X代表卤素原子);