-
下列说法不正确的是( )
A.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量少,速度快
B.1H核磁共振谱能反映出有机物中不同环境氢原子的种数和个数
C.根据红外光谱图的分析可以初步判断有机物中具有哪些基团
D.同位素示踪法可以用来确定有机反应中化学键的断裂位置
难度: 中等查看答案及解析
-
下物质分类组合正确的是 ( )
A B C D
强电解质 HBr FeCl3 H3PO4 Ca(OH)2
弱电解质 HF CH3COOH BaSO4 HI
非电解质 NH3 Cu H2O C2H5OH
难度: 中等查看答案及解析
-
对H2O的电离平衡不产生影响的粒子是( )
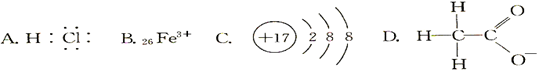
难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.甲烷的标准燃烧热△H=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
B.丙烯的键线式:
C.一定条件下,某密闭容器中充入2 mol SO2(g)和1 mol O2(g),达到平衡后,放出Q kJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g)
2SO3(g ) △H= -Q kJ·mol-1
D.乙烯的结构简式:CH2CH2
难度: 中等查看答案及解析
-
某学生实验仪器的选择及数据记录,都合理的是( )
A.酸碱中和滴定时,用10mL量筒量取10.00mL待测液
B.用托盘天平称量25.20gNaCl固体
C.常温条件下,用广泛pH试纸测得纯水的pH为7.0
D.用500mL容量瓶配制480mL0.100mol/LNaOH溶液
难度: 中等查看答案及解析
-
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是( )

选项 X Y
A. MgSO4 CuSO4
B. AgNO3 Pb(NO3)2
C. FeSO4 Al2 (SO4)3
D. CuSO4 AgNO3
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A.氯气通入水中,溶液呈酸性:Cl2+H2O
2H++Cl-+ClO-
B.用铜做电极电解CuSO4溶液:2Cu2++2H2O
2Cu +O2↑+4H+
C.NaHS电离方程式:NaHS
Na++HS-
D.NH4Cl水解反应:NH4+ +2H2O
NH3·H2O+H3O+
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是( )
A.25℃由水电离的c(H+)= 10-12mol/L 的溶液:Fe3+ Cl- NO3- K+
B.使酚酞变红的溶液:Na+ Cl- SO42- AlO2-
C.某无色溶液:HCO3- NO3- Al3+ Ba2+
D.25℃时,pH=1的溶液: Ba2+ NO3- K+ I-
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的化学方程式为CO+H2O
CO2+H2
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,正反应速率增大,逆反应速率减小
D.该反应的焓变为正值
难度: 中等查看答案及解析
-
下列有机实验操作或叙述正确的是( )
A.甲烷和氯气在室温下的黑暗环境中可以稳定存在
B.苯与浓硝酸、浓硫酸共热并保持100℃-110℃反应生成一取代产物硝基苯
C.苯能使溴水褪色是因为二者反应生成了溴苯
D.要除去乙烷中的乙烯制得纯净的乙烷,可将混合气通入酸性高锰酸钾溶液中
难度: 中等查看答案及解析
-
下列物质:①乙烷 ②乙烯 ③乙炔 ④苯 ⑤甲苯 ⑥聚乙烯,其中既能与溴水反应又能与酸性高锰酸钾溶液反应的是( )
A.②③④ B.②③⑤ C.②③ D.②③⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.1 mol甲基含7 NA个电子
B.1 mol聚乙烯含有的原子数目为6NA
C.标况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA /22.4
D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
难度: 中等查看答案及解析
-
某有机物的分子结构如下所示:CH3-
-CH=CH-C≡C-CH3,该分子中最多可以有多少个原子共面( )
A.18 B.20 C.22 D.24
难度: 中等查看答案及解析
-
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是( )

难度: 中等查看答案及解析
-
下列各组物质中,所含元素的质量分数相同,但它们既不属于同分异构体,也不属于同系物的是( )
A.乙烯 丙烯 B.异戊二烯 3-甲基-1-丁炔 C.苯 苯乙烯 D.甲烷 乙烯
难度: 中等查看答案及解析
-
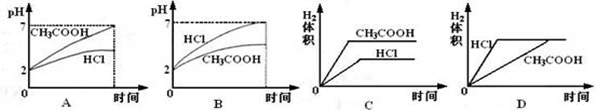
在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是( )
难度: 中等查看答案及解析
-
用已知浓度的NaOH溶液滴定未知浓度的醋酸,下列情况,测得结果偏高的是( )
①用酚酞作指示剂
②滴定管用水洗后,未用标准溶液润洗就装入标准溶液
③锥形瓶盛待测液前,未用待测液润洗
④标准液读数时,滴定前仰视,滴定后俯视
⑤用于取待测液的滴定管未用待测液润洗
⑥在摇动锥形瓶的过程中不慎溅出了一小部分溶液
⑦滴定达终点时发现滴定管尖嘴处挂着一滴液滴
A.①③④ B.②③ C.②⑦ D.④⑤⑥
难度: 中等查看答案及解析
-
对于反应:H2(g)+I2(g)
2HI(g),在一恒定压强的容器中进行,下列可以判断此反应达到平衡状态的是( )
A.混合气体的体积保持不变 B.混合气体的密度保持不变
C.混合气体平均相对分子质量保持不变 D.混合气体颜色保持不变
难度: 中等查看答案及解析
-
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A.20 mL 2 mol/L FeCl3溶液 B.40 mL 1 mol/L NaHCO3溶液
C.20 mL 1 mol/L Na2SO3溶液 D.40 mL 2 mol/L NH4HCO3溶液
难度: 中等查看答案及解析
-
常温常压下,某50mL三种气态烃和足量O2混合后点燃,恢复到原来的状况,体积共缩小100mL,则该混合烃可能是( )
A.CH4 、C2H2 、C2H4 B.C2H6、C3H6 、C4H6
C.CH4 、C3H8 、C2H6 D.C2H2、C2H4、C2H6
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.将0.2mol/L某强碱弱酸盐NaA溶液与0.1mol/L盐酸等体积混合,混合后溶液显碱性,则混合溶液中 c(HA) >c(Cl-) >c(A-)>c(OH-)
B.相同条件下,向氨水、氢氧化钠溶液中分别加入适量的氯化铵晶体后,两溶液的pH:前者减小,后者增大
C.室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,则Va∶Vb=10∶9。
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
难度: 困难查看答案及解析
-
下列事实不能用勒沙特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③把pH=2的NaHSO4溶液加水稀释至10倍,c(OH-)却上升了10倍
④常温下,将1 mL pH=3的醋酸溶液加水稀释至l00 mL,测得其pH<5
⑤在滴有酚酞的Na2CO3溶液中滴CaCl2溶液,生成沉淀的同时溶液颜色由红逐渐变无
⑥对于H2+I2
2HI的平衡体系,加压后密闭体系中的混合气体密度增加
⑦在双氧水的分解实验中添加MnO2能使分解速率显著加快
A、①③④ B、②⑥⑦ C、③④⑤ D、②③⑤
难度: 中等查看答案及解析

