-
分类是化学研究中常用的方法。下列分类方法中,正确的是
A.根据组成元素的种类,将纯净物分为单质和化合物
B.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
C.根据氧化物中是否含有金属元素或非金属元素,将氧化物分为碱性氧化物、酸性氧化物
D.根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
难度: 简单查看答案及解析
-
下列离子方程式中,书写正确的是
A.铝与NaOH溶液反应:2Al +2OH- == 2AlO2-+ H2↑
B.钠与水的反应:Na + H2O == Na+ + 2OH-+ H2↑
C.铜与稀硝酸反应:3Cu + 8H+ + 2NO3-== 3Cu2+ +2NO↑+ 4H2O
D.稀硫酸与氢氧化钡溶液反应:SO42-+ Ba2+==BaSO4↓
难度: 简单查看答案及解析
-
下列各组离子在所给条件下能够大量共存的是
A.pH =0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B.水电离出的c(H+)=1×10-13mol/L的溶液中:K+、HCO3-、Cl-、S2-
C.使紫色石蕊试液显蓝色的溶液中:Mg2+、NO3-、Fe3+、SO42-
D.溶有碳酸氢钠的溶液:K+、SO42-、Cl-、OH-
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,11.2L四氯化碳中所含的分子数为0.5 NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为l mol·L-1的Na2CO3溶液中含有NA个CO32-
难度: 简单查看答案及解析
-
下列有关物质性质的比较中,正确的是
①热稳定性:CH4>NH3>H2O ②还原性:I->Br->CI-
③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O
A.①③ B.②④ C.①④ D.②③
难度: 简单查看答案及解析
-
下图为短周期的一部分,下列关于Y、Z、M元素及其化合物的说法正确的是
A.非金属性:Y>Z>M
B.原子半径:M>Z>Y
C.气态氢化物的稳定性:Y<M<Z
D.ZM2分子中各原子的最外层电子均满足8电子稳定结构
难度: 简单查看答案及解析
-
某温度下,反应H2(g)+I2(g)
2HI(g);△H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是
A.体积不变,升温正反应速率减少
B.温度、压强均不变,充入HI气体,开始时正反应速率增大
C.温度不变,压缩气体的体积,平衡不移动,颜色加深
D.体积、温度不变,充入氦气后,正反应速率将增大
难度: 简单查看答案及解析
-
下表各组物质中,物质之间通过一步反应就能实现如右图所示转化的是
物质选项
a
b
c
d
A
Al
Al(OH)3
NaAlO2
NaOH
B
CH3CH2OH
CH3CHO
CH3COOH
O2
C
Na2CO3
NaHCO3
NaOH
CO2
D
Cl2
FeCl3
FeCl2
Fe
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是
A.苯、乙酸和油脂都可以发生取代反应
B.石油经过分馏得到的汽油、煤油等馏分都是纯净物
C.乙烯、聚乙烯都能使酸性高锰酸钾溶液褪色
D.在一定条件下,葡萄糖、淀粉、蛋白质都可发生水解反应
难度: 简单查看答案及解析
-
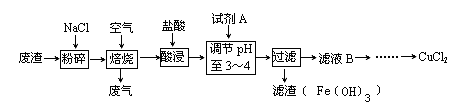
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是

A.①、②中除加试剂外,还需要进行过
滤操作 B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气 D.④进行的操作是加热,而且d一定是氧化铝
难度: 简单查看答案及解析
-
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3+8Na2CO3+7O2高温8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是
A.反应(1)和(2)均为氧化还原反应
B.反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3
C.Na2Cr2O7中Cr元素的化合价为+7
D.反应(1)中生成1mol的Na2CrO4时共转移28mol电子
难度: 简单查看答案及解析
-
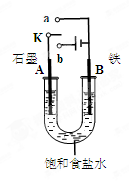
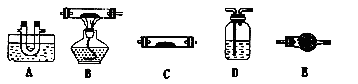
下列装置或操作的叙述中错误的是
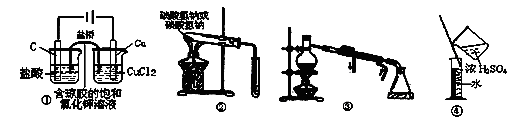
A.①可以用于利用铜与盐酸反应制取氯化铜溶液
B.②可以用于比较碳酸钠与碳酸氢钠的热稳定性
C.③可以从海水中提取淡水
D.④可以用于稀释浓硫酸
难度: 简单查看答案及解析
-
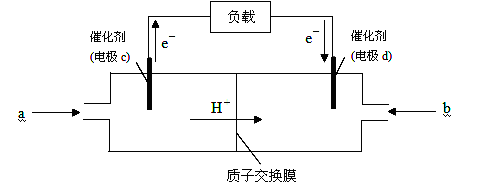
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-===LiFePO4 负极 Li-e-===Li+,下列说法中正确的是
A.充电时电池反应为FePO4+Li === LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时,在正极上是Li+得电子被还原
D.放电时电池内部Li+ 向负极移动
难度: 简单查看答案及解析