-
化学与生活息息相关。下列做法中不合理的是
A. 用食醋除去暖水瓶中的水垢 B. 用活性炭去除冰箱中的异味
C. 用米汤检验食盐中的碘酸钾 D. 生、熟水果混放加快生水果成熟
难度: 简单查看答案及解析
-
下列有关物质的组成、分类和变化的说法正确的是
A. CO2、NO2、SO2均属于空气污染物
B. SiO2、CO、Al2O3均属于酸性氧化物
C. 胆矾、冰水混合物、双氧水都是混合物
D. 煤的干馏、气化和液化都是化学变化
难度: 简单查看答案及解析
-
下列中学课本中涉及的实验,需要通电才能完成的是
① 电解质的电离 ②工业上合成氨 ③证明氢氧化铁胶粒带正电
④ 冶炼大量铝 ⑤ 钢铁的吸氧腐蚀
A. ①⑤ B. ③④ C. ①③⑤ D. 全部
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. 核内有10个中子的氧原子:
B. 乙烯的结构简式:CH2CH2
C. CCl4的电子式:
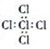 D. 丙烷的球棍模型:
D. 丙烷的球棍模型: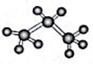
难度: 简单查看答案及解析
-
下列各物质的用途错误的是(括号内为用途)
A. 无水乙醇(用于杀菌消毒) B. 晶体硅(制造计算机芯片)
C. 碳酸氢钠(用作食品发酵剂) D. 氧化铁(制造红色涂料)
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是
A. 常沮常压下,32g甲醇分子中含有C-H键的数目为4NA
B. 常温下,pH=7的任何溶液中含有OH-的数目均为10-7NA
C. 标准状况下,2.24L CO2和N2O混合气体中含有的原子数为0.3NA
D. 常温常压下,5.6gFe投入到足量浓硝酸中,转移电子数为0.3NA
难度: 中等查看答案及解析
-
下列说法错误的是
A. 丙烷和2-甲基丙烷的一氯代物均为两种
B. 乙醇、乙酸和乙酸乙酯可用饱和Na2CO3溶液鉴别
C. 酿酒过程中,葡萄糖可通过水解反应生成酒精
D. 蛋白质在体内不断分解,最后主要生成尿素,排出体外
难度: 中等查看答案及解析
-
酸牛奶中含有乳酸,乳酸具有帮助消化、增进食欲的功能,其结构简式为:
 。下列关于乳酸的说法错误的是
。下列关于乳酸的说法错误的是A. 1mol乳酸与足量金属钠反应生成lmolH2
B. 既是乙醇的同系物,又是乙酸的同系物
C. 可与乙醇、乙酸反应,且反应类型相同
D. 与有机物HOCH2CH2COOH互为同分异构体
难度: 中等查看答案及解析
-
下列实验中颜色变化错误的是
A. 新制氯水久置后,溶液颜色由浅黄绿色逐渐变为无色
B. 用稀盐酸酸化Fe(NO3)2溶液,溶液颜色由浅绿色变为黄色
C. 将二氧化硫通入品红溶液中,溶液褪色,加热后又变为红色
D. 用标准KMnO4溶液滴定Na2SO3溶液,终点时溶液由紫色变为无色
难度: 中等查看答案及解析
-
除去下列各组物质中的少量杂质,所选用的试剂及操作方法均合理的是(括号内的物质为杂质,所选试剂均足量)
选项
物质
试剂
操作方法
A
氮气(氧气)
木炭
点燃
B
乙烷(乙烯)
酸性KMNO4溶液、浓硫酸
洗气、干燥
C
氯化钠固体(硝酸钾)
水
热水溶解、降温结晶、过滤
D
溴化钠溶液(碘化钠)
Br2的四氯化碳溶液
萃取、分液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某溶液中可能大量存在:H+、Na+、Fe2+、Al3+、NH4+、SO42-、Cl-中的几种离子,现进行了如下实验:
① 取该溶液10.0mL,加入过量Ba(NO3)2溶液,产生白色沉淀x和无色气体a,a遇空气立即变为红棕色气体b;过滤。
② 向①所得的滤液中加入过量NaOH溶液,产生红褐色沉淀y,过滤,加热滤液有无色刺激性气体c生成;用铂丝蘸取滤液,在火焰上灼烧,火焰呈黄色。
③ 向②所得的滤液中通入过量CO2气体有白色沉淀z生成。
下列推断错误的是
A. 原溶液一定只含有:Na+、Fe2+、Al3+、SO42-
B. 实验① 的红棕色气体b中存在:2NO2
N2O4。
C. 实验② 中产生沉淀y的反应:Fe3++3OH-=Fe(OH)3↓
D. 实验③ 中CO2先后分别与NaOH(aq)、NaAlO2(aq)反应
难度: 中等查看答案及解析
-
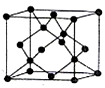
短周期元素x、y、z、m、n在元素周期表中的位置如图所示,则下列说法中错误的是

A. 最高价氧化物的水化物的酸性由弱到强的顺序是m、x、n
B. y、n分别与金属钠形成的化合物中均只含有离子键
C. y、z、n分别形成的简单离子半径的大小为n>y>z
D. x、z、m、n的最高价氧化物对应水化物均能与强碱反应
难度: 中等查看答案及解析
-
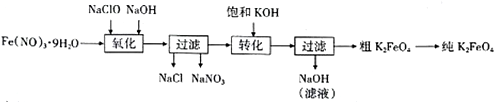
已知:2CuSO4+4KI=2K2SO4+2CuI(白色)+I2。向CuSO4溶液中逐滴加入KI溶液至过量,过滤,再向滤液中通入过量的SO2气体。则下列有关该实验的说法正确的是
A. 滴加KI溶液时,观察到产生白色沉淀,溶液变为无色
B. KI与CuSO4反应时,KI被氧化,CuI是氧化产物
C. 通入SO2时,SO2与I2发生反应,I2作还原剂
D. 上述实验条件下,物质的氧化性:CuSO4>I2>SO2
难度: 中等查看答案及解析
-
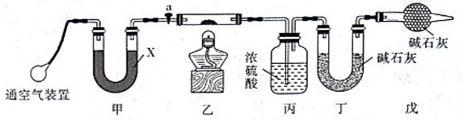
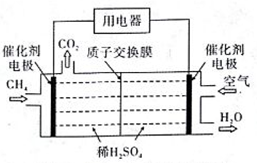
用下图实验装置进行相应实验,不能达到实验目的的是

A. 用图甲装置制备氢氧化亚铁
B. 用图乙装置验正氨气在水中溶解度的大小
C. 用图丙装置进行中和热的测定
D. 用图丁装置实现反应:Cu+2H2O
Cu(OH)2+H2↑
难度: 中等查看答案及解析
-
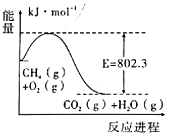
若往10mL 0.1mol/L甲酸(HCOOH)溶液中逐滴加入一定浓度的烧碱溶液,测得溶液的温度变化如图所示.下列说法正确的是
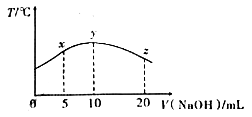
A. 该烧碱溶液的物质的量浓度为0.01mol/L
B. x点溶液中存在:2c(Na+)=c(HCOO-)+c(HCOOH)
C. y点时,甲酸的电离平衡常数最大,且溶液呈中性
D. 从y点到z点,混合溶液中一直存在:c(Na+)>c(HCOO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
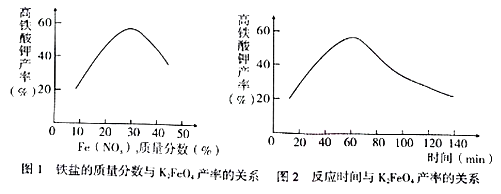
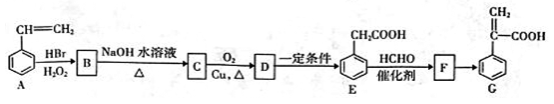
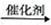 HOCH2CH2COOH
HOCH2CH2COOH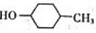 ,请设计合成路线:_______(无机试剂及溶剂任选)。合成路线流程图示例如下:
,请设计合成路线:_______(无机试剂及溶剂任选)。合成路线流程图示例如下: