-
金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关
和
的说法中正确的是
A.
和
原子中均含有22个中子
B.
和
质子数相同
C.
和
质量数不同,不能互称同位素
D.
和
化学性质不同
难度: 简单查看答案及解析
-
分类是科学研究的重要方法,下列物质分类不正确的是
A.化合物:干冰,冰水混合物,烧碱,小苏打
B.非电解质:乙醇,四氯化碳,氯气,葡萄糖
C.同素异形体:活性炭,C60,C80,金刚石
D.混合物:漂白粉,纯净矿泉水,分析纯盐酸,石灰石
难度: 简单查看答案及解析
-
可以证明某化合物一定含有离子键的性质是
A.熔融状态能导电 B.具有较高的熔点
C.可溶于水 D.溶于水能导电
难度: 简单查看答案及解析
-
相关化学用语表示正确的是
A.NH4Br的电子式:
B.S的结构示意图:
C.次氯酸的结构式:H-Cl-O
D.原子核内有18个中子的氯原子:
难度: 简单查看答案及解析
-
支持固态氨是分子晶体的事实是
A.氮原子不能形成阳离子 B.氢离子不能单独存在
C.常温下氨是气态物质 D.氨极易溶于水
难度: 简单查看答案及解析
-
下列变化过程中肯定要放出热量的是
A.H2→H+H B.H+Cl→HCl
C.H2O(l)→H2O(s) D.CaCO3
CaO+CO2
难度: 中等查看答案及解析
-
下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.使红色布条褪色(HCl)
C.使淀粉KI试纸变蓝(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
难度: 中等查看答案及解析
-
下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是
A.盐酸和氢氧化钠反应 B.氯化氢溶于水
C.溴化氢和氨反应 D.锌和稀硫酸反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.有单质生成的分解反应一定是氧化还原反应
B.某元素从化合态变为游离态时,该元素一定被还原
C.氧化剂被氧化,还原剂被还原
D.没有氧元素参加的反应一定不是氧化还原反应
难度: 中等查看答案及解析
-
关于某温度时的饱和溶液的说法中,正确的是
A.已溶解的溶质和未溶解的溶质质量相等
B.溶质不再溶解,因此从表面看溶质不再减少,也不再增加
C.升高温度,饱和溶液将变为不饱和溶液
D.溶质的溶解和结晶继续进行,且速率相等
难度: 中等查看答案及解析
-
反应A+B→C分两步进行:①A+B→X;②X→C。反应过程中能量变化如图所示。下列有关叙述正确的是
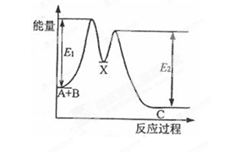
A.E2表示反应X→C的反应热
B.A+B→C此反应放热
C.X是反应A+B→C的催化剂
D.加入催化剂可改变反应A+B→C的反应热
难度: 中等查看答案及解析
-
已知一个SO2分子的质量为n kg,一个SO3分子的质量为m kg(设两种分子中S、O原子分别具有相同的中子数),若以硫原子质量的1/32作标准,SO2的相对分子质量为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
NaF、NaI、MgO均为离子化合物,现有下列数据,试判断三种化合物的熔点、沸点高低的顺序是
物质
①NaF
②NaI
③MgO
离子电荷数
1
1
2
离子的核间距
23.1nm
31.8nm
21.0nm
A.①>②>③ B.③>②>① C.③>①>② D.②>①>③
难度: 困难查看答案及解析
-
对于反应
,下列说法错误的是
A.氧化剂和还原剂都是KMnO4
B.该反应的还原产物只有MnO2
C.该反应的氧化产物是O2
D.KMnO4中Mn元素表现氧化性,O元素表现还原性
难度: 中等查看答案及解析
-
海带中含碘元素,有人设计如下步骤来提取碘:
①通适量Cl2;②将海带烧成灰,向灰中加水搅拌;③加CCl4振荡;④过滤;⑤用分液漏斗分液。正确的步骤顺序是
A.①③⑤②④ B.②④③①⑤ C.②④①③⑤ D.③①②⑤④
难度: 中等查看答案及解析
-
化学反应的离子方程式正确的是
A.醋酸溶液与NaOH反应:OH-+H+→H2O
B.硝酸溶液和碳酸氢钠反应:H++2CO32-→CO2↑+H2O
C.将溴水加入KI溶液中:Br2+2I-→I2+2Br-
D.CO2通入澄清石灰水:2OH-+CO2→H2O+CO32-
难度: 中等查看答案及解析
-
硫代硫酸钠可作为脱“氯”剂,已知25.0mL 0.100mol/L Na2S2O3溶液恰好把0.01mol Br2完全转化为Br-离子,则S2O32-将转化成
A.S2- B.S C.SO32- D.SO42-
难度: 中等查看答案及解析
-
用下列实验装置和方法进行相应实验,能达到实验目的的是
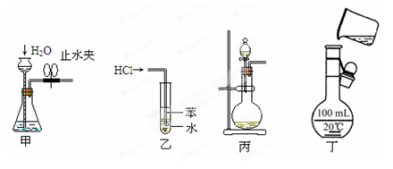
A.用图甲所示方法检查装置的气密性
B.乙图装置可用于吸收HCl气体,并防止倒吸
C.大理石和稀硫酸反应制CO2时选用丙图装置
D.用丁图所示装置将溶液定容到100mL
难度: 中等查看答案及解析
-
对于铜锌原电池实验后得出的结论和认识中,正确的是
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌电极与硫酸铜溶液组成的原电池中铜是负极
C.电子由锌片流经稀硫酸溶液到铜片,氢离子在铜片上得到电子放出氢气
D.铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过
难度: 中等查看答案及解析
-
碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于HCl,转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜。溶解28.4g的上述混合物,消耗1.0 mol/L盐酸500mL。灼烧等量的上述混合物,得到氧化铜的质量为
A.35g B.30g C.20g D.15g
难度: 困难查看答案及解析