-
常温下,下列离子浓度关系正确的是( )
A. pH=4的CH3COOH溶液中,c(H+)= c(CH3COO-)=4.0mol·L-1
B. pH=5的CH3COOH和CH3COONa混合溶液中,c(CH3COO-)>c(Na+)
C. 0.1 mol·L-1CH3COONa溶液中,c(Na +)>c(OH-)>c(CH3COO-)>c(H+)
D. 0.1 mol·L-1CH3COONa溶液中,c(Na +)= c(CH3COO-)+ c(OH-)
难度: 困难查看答案及解析
-
能证明乙酸是弱酸的实验事实是( )
A. CH3COOH溶液与Zn反应放出H2
B. 常温下,0.1 mol/L CH3COONa溶液的pH大于7
C. CH3COOH溶液与Na2CO3反应生成CO2
D. 0.1 mol/L CH3COOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3•H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A. 未加盐酸时:c(OH-)>c(Na+)= c(NH3•H2O)
B. 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-)
C. 加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D. 加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
难度: 中等查看答案及解析
-
下列物质能促进水的电离的是( )
A. 小苏打 B. 醋酸 C. 乙醇 D. 氯化钠
难度: 中等查看答案及解析
-
在容积可变的密闭容器中,1molN2和4molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于( )
A. 5% B. 10% C. 15% D. 20%
难度: 中等查看答案及解析
-
关于下列装置的说法正确的是
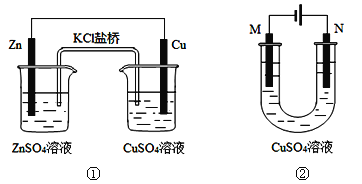
A. 装置①中盐桥内的K+移向CuSO4溶液
B. 装置①将电能转变为化学能
C. 若装置②用于铁棒镀铜,则N极为铁棒
D. 若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变
难度: 简单查看答案及解析
-
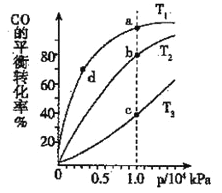
已知反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
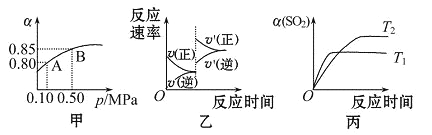
A. 由图甲知,B点SO2的平衡浓度为0.3mol·L-1
B. 由图甲知,A点对应温度下的平衡常数为80
C. 达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
难度: 中等查看答案及解析
-
现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50 mL)。下列叙述错误的是( )
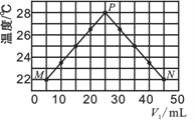
A. 实验的环境温度低于 22℃
B. P点的混合溶液的pH=7
C. 混合溶液的导电能力:M > N
D. 若将CH3COOH改为HCl,P点温度高于 28℃
难度: 困难查看答案及解析
-
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是( )
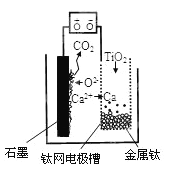
A. 将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的
B. 阳极的电极反应式为:C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 石墨为阴极
难度: 困难查看答案及解析
-
下列不能用勒夏特列原理解释的事实是( )
A. 碳酸钙不溶于水,但溶于盐酸
B. 由2NO2(g)
N2O4(g)组成的平衡体系,加压后颜色加深
C. 高压比常压有利于合成氨的反应
D. 用热的纯碱溶液洗油污时,去污效果好
难度: 中等查看答案及解析
-
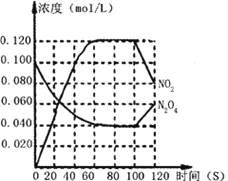
下列关于各图像的解释或结论正确的是

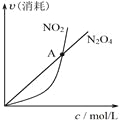
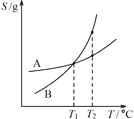

甲 乙 丙 丁
A. 由甲可知:热化学方程式是H2(g) +
O2(g) = H2O(g) △H=﹣241.8kJ/mol
B. 由乙可知:对于恒温恒容条件下的反应2NO2(g) ⇌N2O4(g),A点为平衡状态
C. 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A
D. 由丁可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
难度: 简单查看答案及解析
-
一定温度下,水溶液中H+和OH-的浓度变化曲线如下图,下列说法正确的是( )
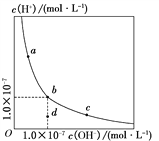
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
难度: 中等查看答案及解析
-
工业上用CO和H2合成CH3OH:CO(g)+2H2(g)
CH3OH(g)。平衡常数如下表:下列说法正确的是( )
温度/℃
0
100
200
300
400
平衡常数
667
13
1.9×10-2
2.4×10-4
1×10-5
A. 该反应的△H> 0
B. 加压、增大H2浓度和加入催化剂都能提高CO的转化率
C. 工业上采用5 ×103 kPa和 250℃的条件,其原因是原料气的转化率高
D. t℃时,向 1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
难度: 中等查看答案及解析
-
常温下pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是
A.乙酸溶液中水的电离程度比NaOH溶液中的小
B.乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+)
C.若两溶液混合后pH=7,则有:c(Na+)= c(CH3COOH) + c(CH3COO-)
D.分别稀释10倍,两溶液的pH之和大于14
难度: 中等查看答案及解析
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)
COS(g)+H2(g) K=0.1。 反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
难度: 简单查看答案及解析
-
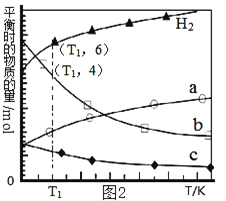
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)
xC(g)△H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时问变化的关系如图2.
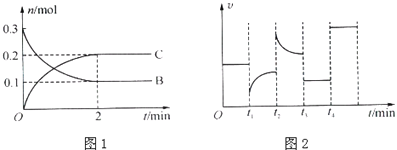
下列有关说法中正确的是
A. x=2,反应开始2 min内,v(A)=0.05mol•L﹣1•min﹣1
B. t1时改变的条件是降温,平衡逆向移动
C. t2时改变的条件可能是增大C的浓度,t2时正反应速率减小
D. t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
难度: 困难查看答案及解析
-
常温下,在等体积①pH=0的硫酸、②0.01mol/L NaOH溶液、③pH=10的纯碱溶液、④pH=5的NH4Cl溶液中,水电离程度的大小顺序是 ( )
A. ①>②>③>④ B. ②>①>④>③ C. ③>④>②>① D. ④>③>②>①
难度: 中等查看答案及解析
-
利用如图装置进行实验,甲乙两池均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是
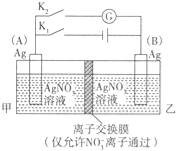
A闭合K1,断开K2后,A电极增重
B闭合K1,断开K2后,乙池溶液浓度上升
C断开K1,闭合K2后,NO3-向B电极移动
D断开K1,闭合K2后,A电极发生氧化反应
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g)
2Z(g)△H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是( )
t /min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A. 反应前2min的平均速率v(Z) = 2.0×10-3mol/(L•min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆) > v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 困难查看答案及解析
-
使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)
4N2(g)+6H2O(g),下图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是( )
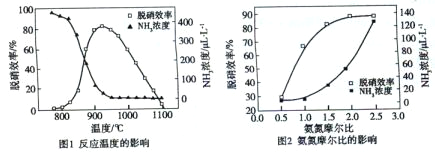
A. 从图1判断,该反应的正反应方向是放热反应
B. 从图2判断,减少氨气的浓度有助于提高NO的转化率
C. 从图1判断,脱硝的最佳温度约为 925℃
D. 从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5
难度: 困难查看答案及解析