-
能源是人类生存与发展必不可缺的物质,对传统能源进行脱硫、脱硝处理,能提高能源在能源消费中的比例是改变目前我国频发的雾霾天气的有效措施。
(1)肼(N2H4)和化合物甲是一种重要的火箭推进剂,甲分子与肼分子具有相同的电子数,二者反应的生成物中有10e-分子,另一种生成物为极稳定的单质,写出该反应的化学方程式__________________。
(2)对燃煤产生的尾气进行回收处理,有助于空气质量的改善,还能变废为宝,尾气处理过程中涉及到的主要反应如下:
①2CO(g)+SO2(g)=S(g)+2CO2(g) △H=十8.0 kJ·mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g) △H=+90.4 kJ·mol-1
③2CO(g)+O2 (g) =2CO2 (g) △H= -566.0 kJ·mol-1
④2H2 (g)+O2 (g) =2H2O(g) △H =-483.6 kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式为__________________。
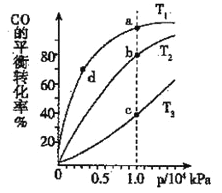
(3)煤炭液化也有助于减少雾霾天气的发生,液化反应之一为:CO(g)+2H2(g) CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________。
CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________。
(4)工业上生产新能源二甲醚(CH3OCH3)的原理之一为:2CO(g)+6H2(g)  CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
| 容器 | c(CO) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)与v(逆)大小比较 |
| I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)= v(逆) |
| II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v(正)____v(逆)(填“>”、“<”) |
填写表中空白处,并写出其推测过程___________。
(5)二甲醚(燃烧热为1455kJ/mol)燃料电池是一种绿色电池,其工作原理如图所示,a、b均为惰性电极,a极的电极反应式为________________________;当消耗1molO2时,通过质子交换膜的质子数为_________NA;若电池工作时消耗1mol二甲醚所能产生的最大电能为1320kJ,则该燃料电池的工作效率为________(燃烧电池的工作效率是指电池所能产生的最大电能与燃料燃烧时所能释放的全部热能之比)。

-
防治酸雨是一项综合性工程,下列叙述正确的是
A.从消除污染源着手,研究开发能替代化石燃料的新能源
B.利用物理及化学方法对含硫燃料预先进行脱硫处理
C.提高全民环境保护意识,加强国际间合作,全人类共同努力以减少酸雨的产生
D.将烟囱建得更高些,避免SO2排放在本地
-
能源是人类生存和发展的重要支撑因素。常规能源(煤、石油、天然气等)日益减少,促使人们研究能源的利用率和新能源(如太阳能、氢能、核能等)的开发。
(1)我国目前最主要的能源品种是____________,能源利用中存在的主要问题有___________________。
(2)为减少污染,提高燃料利用率,下列措施中可以达到目的的是______(填序号)。
①将城市居民燃煤改为使用气体燃料
②若将原来烧天然气的灶具改烧液化石油气,应增大空气进入量或减小液化石油气的进入量
③在农村大力发展沼气
(3)下列关于能源和作为能源的物质的叙述中错误的是_______(填序号)。
①化石能源物质内部蕴藏着大量的能量
②绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
③物质的化学能可以在不同条件下转化为热能、电能为人类所利用
④吸热反应没有利用价值
(4)科学家用铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用_______________________。
-
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
(2)下图是某市污水处理的工艺流程示意图:
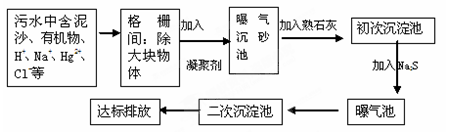
① 下列物质中不可以作为混凝剂(沉降剂)使用的是________(填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是________(填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(3)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 = KOCN + 2KCl + H2O 再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯________g。
-
酸雨给人类带来了种种灾祸,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是
①对燃煤进行脱硫;②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中;③人工收集雷电作用所产生的氮的氧化物;④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等。
A.①②③④ B.①②③ C.①②④ D.①③④
-
能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今人类社会面临的严峻课题。回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是________。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乌克兰科学家将铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用是_________________________________________________。
(3)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,表示乙醇燃烧热的化学方程式为__________________________________。
-
能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的开发是当今社会人类面临的严峻课题。回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是_______
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料合算
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化以及烟气 脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乌克兰科学家将铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用是_____________________。
-
煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出。目前我国采用的控制方法是电厂烟气脱硫。烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
I、钠碱循环法脱硫技术。
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式: 。
(2)NaOH溶液吸收SO的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c.c(Na+)=2c(SO32-)+c(HSO3-)
II、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s) 的热化学反应方程式 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp= (用表达式表示)。
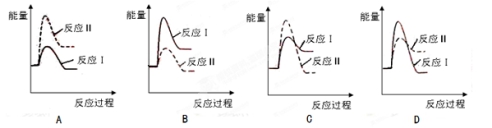
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中产生的SO2生成量的措施有 。
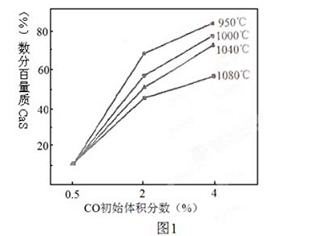
A、向该反应体系中投入生石灰
B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数
D、提高反应体系的温度
-
目前,在研究新能源的前沿技术上,科学家致力于二氧化碳的“组合转化”技术的研究,把过多的二氧化碳转化为有益于人类的物质。
(1)乙烯的产量是衡量一个国家石油化工发展水平的标志之一,下列石油化工生产能提高乙烯的产量的是________。
A.蒸馏、分馏 B.催化裂化
C.催化裂解 D.催化重整
(2)下列说法不正确的是__________。
A.石油是混合物,分馏后得到的馏分是纯净物
B.煤隔绝空气加强热可以得到黑褐色油状的煤焦油
C.煤的气化和液化是使煤变成清洁能源的有效途径
D.从绿色化学角度考虑,以植物为主的生物质资源,是未来的理想资源
(3)如果将CO2和H2以1∶4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:
CO2+4H2―→(__________)+2H2O
(4)若将CO2和H2以1∶3的比例混合,使之发生反应生成某种重要的化工原料和水,该原料可能是________。
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(5)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
原料— →CO(NH2)2
→CO(NH2)2
①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?________。
(6)请根据以上信息,设计工业合成尿素的条件_________________________。
-
能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是 ___________________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式为____________________________________________________________。
(3)由于C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ•mol−1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
(4)关于用水制取二次能源氢气,以下研究方向不正确的是________________
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(5)已知下列两个热化学方程式:
A、2H2(g)+O2(g) ===2H2O(l) △H=-571.6 kJ•mol-1 B、C3H8(g)+5O2(g) ===3CO2(g)+4 H2O(l) △H=-2 220 kJ•mol-1,其中,能表示燃烧热的热化学方程式为___________(A或B),其燃烧热为______________。
CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________。

CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:



