-
资源的回收和合理利用可促进社会的可持续发展。下列说法正确的是
A.用二氧化碳生产肥料可以缓解温室效应
B.通过铝热反应回收金属铝
C.处理废水时加入明矾作为消毒剂可以除去水中的杂质
D.直接焚烧废旧塑料,防止白色污染
难度: 简单查看答案及解析
-
下列有关化学用语正确的是
A.NH4Cl的电子式:
B.含18个中子的氯原子的核素符号:1735Cl
C.S2-的结构示意图:
D.次氯酸的结构式:H—O—Cl
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3-
B.10 mol·L-1的浓氨水:Al3+、NH4+、NO3-、I—
C.0.1 mol·L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl—
D.c(H+)/c(OH—)=1×10—12的溶液:K+、Na+、AlO2—、CO32—
难度: 中等查看答案及解析
-
下列有关物质应用的说法不正确的是
A.氯气用于制备漂白粉
B.单质硅用于制造光导纤维
C.氧化铝的熔点很高,可用于制作耐高温材料
D.三氧化二铁用于生产红色颜料
难度: 简单查看答案及解析
-
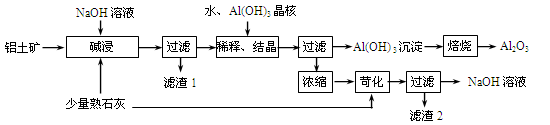
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是
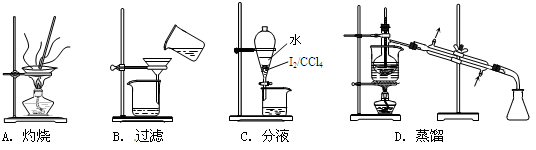
难度: 简单查看答案及解析
-
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
物质
组别
甲
乙
丙
A
Al
HCl
NaOH
B
NH3
O2
HNO3
C
SiO2
NaOH
HF
D
SO2
Ca(OH)2
NaHCO3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,71g Cl2中含有的氯原子数目为NA
B.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
C.46 g 由NO2与N2O4组成的混合气体含有的原子数目为3NA
D.1 L 0.1 mol·L-1 FeCl3溶液中含有的Fe3+离子数目为0.1NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向氯化铝溶液通入过量的氨气:Al3+ +4OH-
AlO2- +2H2O
B.过量氯气通人溴化亚铁溶液中2Cl2 +2Fe2+ +2Br-
4Cl-+2Fe3++ Br2
C.次氯酸钠与浓盐酸反应产生Cl2:ClO-+Cl—+H2O=Cl2↑+2OH—
D.NaHCO3溶液与少量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-=BaCO3↓+CO32—+2H2O
难度: 中等查看答案及解析
-
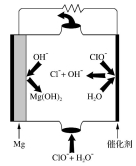
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海 水为电解质溶液,示意图如下。
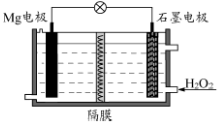
该电池工作时,下列说法不正确的是
A.Mg电极是该电池的负极
B.H2O2在石墨电极上发生还原反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C是金属元素,B是地壳中含量最多的元素,A元素常见化合价为+1和-1;A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍。下列叙述正确的是
A.元素的原子半径:A<B<C<D< E
B.对应氢化物的热稳定性:D > E
C.B与C、B与D形成的化合物中化学键类型相同
D.五种元素中最高价氧化物对应的水化物酸性最强的是E
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0
D.
达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高
难度: 简单查看答案及解析
-
国庆期间对天安门广场大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
A.其分子式为C15H18O4
B.1mol该物质与NaOH溶液反应,最多可消耗2mol NaOH
C.既能发生加成反应,又能发生取代反应和消去反应
D.既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结论
A
向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液
试管口出现红棕色气体
溶液中NO3-被Fe2+还原为NO2
B
向溶液中先滴加稀盐酸,再滴加BaCl2溶液
先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀
溶液中一定含有SO42-
C
用洁净铂丝蘸取某溶液置于酒精灯火焰上灼烧
火焰呈黄色
溶液中含Na+,无K+
D
湿润的KI淀粉试纸靠近气体Y
试纸变蓝
Y一定是Cl2
难度: 中等查看答案及解析
-
下列有关溶液中微粒浓度关系的叙述正确的是
A.0.1 mol·L-1NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3—)+c(H2CO3)+c(CO32—)
C.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
D.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)=c(NH4+)=c(Cl-)
难度: 困难查看答案及解析
-
温度为T时,向2.0 L恒容密闭容器中充入2.0 mol NO2,反应2NO2(g)
N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(N2O4)/mol
0
0.12
0.18
0.20
0.20
下列说法正确的是
A.反应在前50 s的平均速率为v(NO2)=0.001 2 mol·L-1·s-1
B.保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)<v(逆)
C.保持其他条件不变,升高温度达到新平衡时K=0.125,则反应的ΔH<0
D.T温度时,若起始向容器中充入2.0 mol N2O4,则平衡时N2O4的转化率大于80%
难度: 中等查看答案及解析