-
.已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为________,1mol M中含有σ键的数目为________。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是________。
(3)写出与BD2互为等电子体的C3-的结构式________。
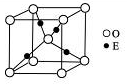
(4)E+的核外电子排布式为 ________________,下图是E的某种氧化物的晶胞结构示意图,氧的配位数为________________。
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式:________。
-
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
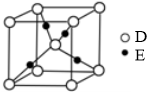
(4)E+的核外电子排布式为 ,下图是D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。
(5)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+配离子,1 mol [E(CA3)4]2+中含有σ键的数目为 。
-
【化学——物质结构与性质】(15分)
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为,
1mol M中含有σ键的数目为________。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是________。
(3)写出与BD2互为等电子体的C3-的结构式。
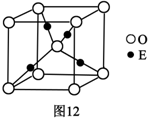
(4)E+的核外电子排布式为 ________________,图12是E的某种氧化物的晶胞结构示意图,氧的配位数为________________。
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式:________。
-
[化学选修3:物质结构与性质]
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为______,其中心原子采取______杂化;化合物N在固态时的晶体类型为______.
(2)R、X、Y三种元素的第一电离能由小到大的顺序为______;
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为______(写分子式)
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质.该反应的离子方程式为______.
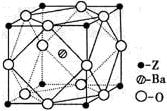
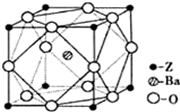
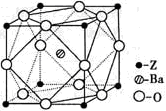
(5)Z原子基态时的外围电子排布式为______;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为______.
-
[化学-选修物质结构与性质]
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题:(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)RQ4Y分子的某中心原子采用的杂化轨道类型是______杂化.
(2)R、X、Y三种元素的第一电离能由小到大的顺序为______.
(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与RY分子互为等电子体的分子和离子分别为______和______(填化学式).
(4)Z元素位于周期表的______分区.Z原子基态时的外围电子排布式为______,Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个“Z”原子等距离且最近的氧原子数为______.
-
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
① Q为元素周期表中原子半径最小的元素;
② R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③ Y的基态原子的核外成对电子数是未成对电子数的3倍;
④ Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示):
(1)Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,化合物M的空间构型为____________ ,其中心原子采取_______杂化;Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,化合物N在固态时的晶体类型为____。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为________________。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为_____(写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质,该反应的离子方程式为_________________________。
(5)某含Z配合物,化学式为[ZCl(H2O)5]Cl2, 配位数为____,1 mol该配合物中 键的数目为___。
键的数目为___。
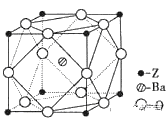
(6)Z原子基态时的价电子排布式为__________;已知Z的一种含氧酸钡盐的密度为ρ g.cm-3,其晶胞的结构如图所示,则晶 体中氧原子与钡原子的最近距离为_______cm。(只要求列算式, 不必计算出数值。阿伏伽德罗常数为NA)
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
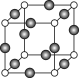
(5)Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
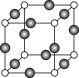
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
-
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示):
(1)Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,化合物M的空间构型为 ,其中心原子采取 杂化;Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,化合物N在固态时的晶体类型为 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物
质,该反应的离子方程式为 。
(5)Z原子基态时的外围电子排布式为 ;已知Z的一种含氧酸钡盐的密度为ρ g.cm-3,其晶胞的结构如图所示,则晶 体中氧原子与钡原子的最近距离为 cm。(只要求列算式, 不必计算出数值。阿伏伽德罗常数为NA)
-
【化学选修3:物质结构与性质】(15分)
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。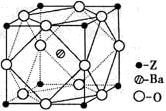
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为________ ,其中心原子采取________杂化;化合物N在固态时的晶体类型为________。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为________;
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为________(写分子式)
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为________。
(5)Z原子基态时的外围电子排布式为________;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为________









