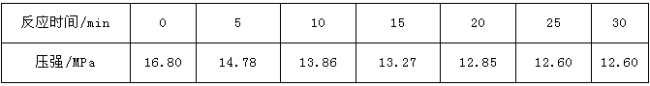
-
下列关于有机物的说法正确的是( )
A.有机物都不溶于水,且易燃,受热易分解
B.有机物只能从有机生命体中获得
C.组成中仅含C、H两种元素的有机物都叫做烃
D.有机物种类繁多的主要原因是碳原子之间的连接方式不同
难度: 中等查看答案及解析
-
下列化学用语书写正确的是( )
A.作为相对原子质量标准的原子
B.氯化镁的电子式:

C.用电子式表示氯化氢分子的形成过程:

D.HClO的结构式为:H-Cl-O
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.
、
互为同位素
B.H2O、D2O、T2O的化学性质不同
C.
 和
和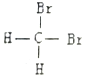 是两种不同结构
是两种不同结构D.白磷与红磷互为同素异形体
难度: 中等查看答案及解析
-
下列说法不正确的是( )
①放热反应的反应速率总是大于吸热反应的反应速率
②所有的化学反应都伴随着能量变化
③放热反应发生时不必加热,吸热反应在加热后才能发生
④101KPa下1molC(s)和2molC(s)的燃烧热不同
⑤化学反应的热效应数值只与参加反应的物质的多少有关
⑥同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同
⑦依据盖斯定律,反应焓变的大小与反应的途径有关
A.除②外 B.全部 C.③⑤⑦ D.①③④⑤⑦
难度: 中等查看答案及解析
-
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①移去生成物 ②升高温度 ③增大压强 ④增大反应物的浓度 ⑤加入催化剂
A.①②③④⑤ B.②③④⑤ C.②⑤ D.③④
难度: 中等查看答案及解析
-
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
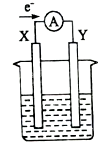
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C.若两电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.L层上的电子数为奇数的原子一定是主族元素的原子
B.元素周期表中只有第IIA元素的原子最外层有两个电子
C.元素周期表中第Ⅷ族分占8、9、10三列,是元素种类最多的一族
D.元素周期表中位于金属和非金属交界线附近的元素属于过渡元素
难度: 中等查看答案及解析
-
下列有关化学键的叙述,不正确的是( )
A.非金属元素构成的单质中一定存在共价键
B.由不同种原子间形成的共价键不一定是极性键
C.含有共价键的化合物不一定是共价化合物
D.化学键断裂,不一定发生化学变化
难度: 中等查看答案及解析
-
有关碱金属、卤素结构和性质描述正确的是( )
①随着核电荷数的增加,碱金属单质、卤素单质的熔沸点依次升高,密度依次增大
②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易于氧气发生反应,加热时生成氧化物R2O
④砹是原子序数最大的卤族元素,根据卤素性质的递变规律,At与H2化合最容易
⑤从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
⑥碱金属都应保存在煤油中
⑦卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大起主要作用
⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳
A.全部正确 B.⑦⑧ C.①③⑤⑥⑦ D.①③⑦⑧
难度: 中等查看答案及解析
-
已知反应2NO(g)+Br2(g)=2NOBr(g)的活化能为akJ/mol,其反应机理如下:
(1)NO(g)+Br2(g)=NOBr2(g)(慢); (2)NO(g) +NOBr2(g)=2NOBr(g) (快)
下列有关该反应的说法正确的是( )
A.反应速率主要取决于(2)的快慢
B.NOBr2是该反应的催化剂
C.该反应的焓变等于akJ•mol-1
D.反应速率:v(NO)=v(NOBr2)=2v(Br2)
难度: 中等查看答案及解析
-
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是
4Li+FeS2=Fe+2Li2S。下列说法不正确的是( )
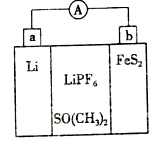
A.该装置将化学能转化为电能
B.电子移动方向是由a极流向b极
C.可以用水代替SO(CH3)2作溶剂
D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S
难度: 中等查看答案及解析
-
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)
H2(g)+I2(g)。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
A.等于Ss B.等于10 s C.大于10 s D.小于10 s
难度: 中等查看答案及解析
-
现有下列短周期元素性质的数据,下列说法正确的是( )
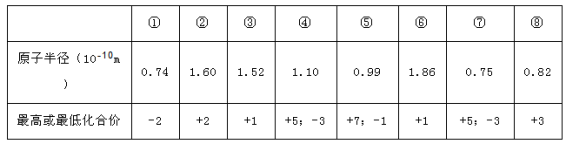
A.⑧号元素为Al
B.上述八种元素最高价氧化物对应的水化物⑤号酸性最强
C.②、③处于同一周期
D.④元素的气态氢化物沸点大干⑦元素的氢化物
难度: 中等查看答案及解析
-
一定温度下,在固定容积的密闭容器中进行的可逆反应:mA(g)+nB(g)
pC(g)+qD(g),,当m、n、p、q为任意正整数时,下列状态一定能说明反应已达到平衡的是( )
①体系的压强不再改变
②体系的密度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q
A.③④ B.②③④ C.①②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)
2C(g)+D(g),经2min反应达到了平衡,此时B的浓度减少了0.6mol/L。对此反应的叙述正确的是( )
A.用A表示的反应速率是0.4mol/(L·min)
B.分别用B、C、D表示反应的速率,其比值是3:2:1
C.若在恒容时充入与反应无关的气体Ar,由于增大了容器内的压强,而加快了反应速率
D.当B的消耗速率与C的消耗速率相等时,反应达到了平衡
难度: 中等查看答案及解析
-
己知热化学方程式:①CO(g)+l/2 O2(g)=CO2(g) △H = -283.0kJ/mol
②H2(g)+ l/2O2(g)=H2O(g) △H =-241.8 kJ/mol
则下列说法正确的是( )

A.H2的燃烧热为241.8 kJ/mol
B.由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2 kJ/mol
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2 (g)+l/2O2(g)=H2O(1) △H>-241.8 kJ/mol
难度: 中等查看答案及解析
-
下图是部分短周期元素原子序数与最外层电子数之间的关系图,下列说法中正确的是( )

A.元素对应的离子半径:Z>M>R>W
B.简单氢化物的沸点:W>R>Y>X
C.气态氢化物的稳定性:X>Y>R>W
D.Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应
难度: 中等查看答案及解析
-
己知热化学方程式如下:CaSO4(s) +CO (g)
CaO(s)+SO2(g)+CO2(g) △H 1= +218.4kJ/ mol (反应I) CaSO4 (s) +4CO (g)
CaS (s)+4CO2(g) △H2= -175.6kJ/mol(反应II)
假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是( )

难度: 中等查看答案及解析
-
原子序数依次增大的短周期元素W、X、Y、Z分别位于不同的奇数主族,且它们的简单离子的电子层结构相同,下列叙述正确的是( )
A.W的单质的熔点最高
B.X元素的非金属性最强
C.最高价氧化物的水化物按酸性增强,碱性减弱的顺序是Y、Z、W、X
D.Z的原子半径最大
难度: 中等查看答案及解析
-
把下列四种X溶液分别加入四个盛有l0mL2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸进行反应,其中反应速率最快的是( )。
A.10℃ 20mL 3mol/L的X溶液 B.20℃ l0mL 5mol/L的X溶液
C.20℃ 30mL 2mol/L的X溶液 D.10℃ l0rnL 2mol/L的X溶液
难度: 中等查看答案及解析
-
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )

A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
难度: 中等查看答案及解析
-
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+C1-+3H+,已知该反应的速率随溶液酸性的增强而加快。右图为用C1O4-在单位时间内的物质的量浓度的变的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
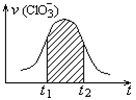
A.反应开始时速率增大可能是c(H+)增大引起的
B.纵坐标为v(H+)的速率-时间曲线与图中曲线不能完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.图中阴影部分“面积”为t1 至t2 时间内的ClO3- 的物质的量浓度的减小值
难度: 中等查看答案及解析
-
当浓度恒定时,A、B两种物质在不同温度下进行反应:A+3B
3C。10℃时,反应率v(B)=0.3mol/(L·s);50℃时,反应速率v(A)=25.6mol/(L·s)。若该反应温度升高10℃反应速率增至原来的n倍,则n值为( )
A.4 B.3 C.3.5 D.2.5
难度: 中等查看答案及解析
-
绿色电源“二甲醚【(CH3)2O】—氧气燃料电池”的工作原理如下图所示,下列说法正确的是( )
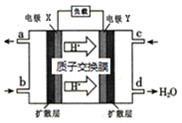
A.氧气应从c处通入,电极Y上发生的反应为:O2+4e-+2H2O=4OH-
B.电池在放电过程中,电极X周围溶液的pH增大
C.当该电池向外电路提供2 mol电子时消耗O2约为11.2L
D.二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O-12e-+3H2O=2CO2+12H+
难度: 中等查看答案及解析
-
如下图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL。在相同温度、压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)
2Z(g)+W(g);△H<0。达平衡时,A的体积为1.4aL。下列说法错误的是( )

A.反应速率:v(B)>v(A)
B.A容器中X的转化率为80%
C.平衡时的压强:PB=PA
D.平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率
难度: 中等查看答案及解析