-
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为________________;正极反应式为_________________________。
(2)下列措施可以加快合成氨反应速率的是_________。
A.通过缩小容器的容积增大压强
B.及时将氨液化分离出去
C.适当升温
D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
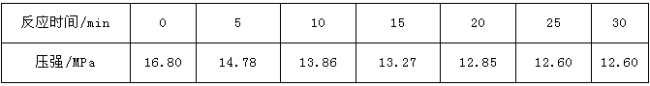
则从反应开始到25 min时,①以N2表示的平均反应速率为________;②H2的平衡转化率为____________;
(4) 以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=+116kJ·mol-1
③H2O(l)=H2O(g);ΔH=+44kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________。
-
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、按盐和纯碱等的原料。
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH 溶液作电解质溶液,则该电池负极电极反应式为_______________;正极反应式为______________。
(2)下列措施可以加快合成氨反应速率的是______________。
A.通过缩小容器的容积增大压强 B.及时将氨液化分离出去
C.适当升温 D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入lmolN2 和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则①从反应开始到25min时,以N2表示的平均反应速率为________;
②H2的平衡转化率为_______________;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=+116kJ·mol-1
③ H2O(l)=H2O(g);△H=+44kJ·mol-1
写出CO2 与NH3 合成尿素和液态水的热化学反应方程式_____________。
-
关于工业生产的叙述,错误的是 ( )。
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化生成三氧化硫后,在吸收塔内用水吸收制得浓硫酸
D.制造普通水泥的主要原料是黏土、石灰石
-
(10分)氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研 究性学习小组做了以下实验:
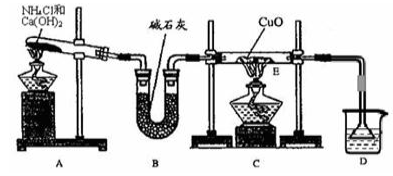
(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。)
①实验室制取氨气的化学方程式为 。
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置B的作用是 。
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性。
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。
已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。
下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀)===6Cu(NO3)2 + 2NO↑+ 7H2O】___________
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L
-
硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取硝基的炸药等。有机化工中也用硝酸与丙烯或乙烯、乙二醇作用制取草酸。
(1)某同学对铁与稀硝酸的反应进行探究,若稀HNO3只被还原成NO。
①写出铁与过量稀硝酸反应的离子方程式_______________________________。
②写出过量铁与稀硝酸反应的离子方程式_______________________________。
③若28克铁与含1.6摩尔硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比__________________。
④上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为_________g。
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中的NO3-浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:____Al+___NO3-+___OH-==___AlO2-+___N2↑+_________。
②上述反应中,还原剂与还原产物的物质的量之比是____,反应中转移电子0.3mol,标准状况下生成N2是___________mL。
-
化学工业是国民经济的支柱产业,下列生产过程中不涉及氧化还原反应的是
A.氮肥厂用氮气和氢气合成氨气 B.硝酸厂用氨氧化法制硝酸
C.从海水中提溴 D.纯碱厂用NaCl、NH3、CO2等制纯碱
-
下列用途中应用了氮气的稳定性的是:( )
A. 以氮气为原料之一制造硝酸 B. 合成氨气后,制氮肥
C. 金属焊接时的保护气 D. 镁可以和氮气反应
-
下列用途中应用了氮气的稳定性的是:( )
A. 以氮气为原料之一制造硝酸 B. 合成氨气后,制氮肥
C. 金属焊接时的保护气 D. 镁可以和氮气反应
-
下列用途中应用了氮气的稳定性的是:( )
A.以氮气为原料之一制造硝酸
B.合成氨气后,制氮肥
C.金属焊接时的保护气
D.镁可以和氮气反应
-
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________。
(2)已知:
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si |
| 键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为
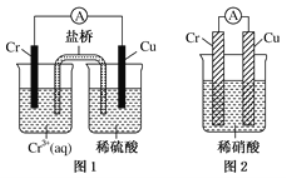
① ____________________________________。
② ____________________________________。


