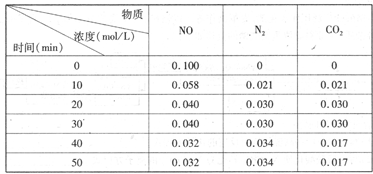
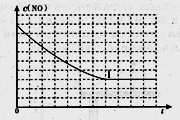
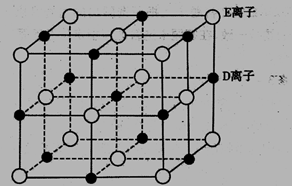
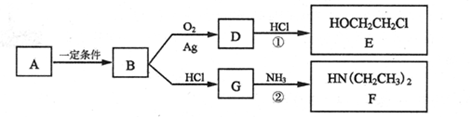
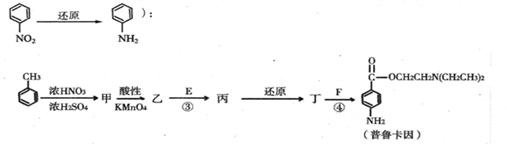
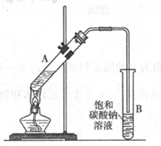
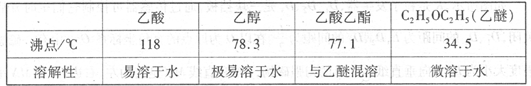
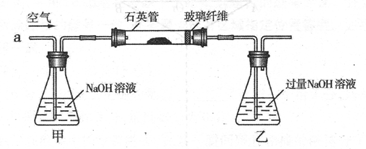
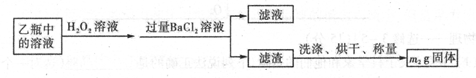
-
根据生活经验,下列物质按酸碱性的一定顺序依次排列,正确的是
A.厕所清洁剂 厨房清洁剂 醋 肥皂
B.醋 厕所清洁剂 洗衣液 厨房清洁剂
C.厕所清洁剂 醋 肥皂 厨房清洁剂
D.厨房清洁剂 醋 肥皂 厕所清洁剂
难度: 简单查看答案及解析
-
下列有关铝或其化合物的说法中不正确的是
A.制备AlCl3不能采用将溶液直接蒸干的方法
B.工业上采用电解AlCl3的方法冶炼金属铝
C.实验室常用氨水和硫酸铝溶液制备Al(OH)3
D.存在于污水中的胶体物质,常用投加明矾等电解质的方法进行处理
难度: 中等查看答案及解析
-
下列物质的除杂方法中,合理的是
①C2H6中混有的C2H4,可以将混合气体先通过溴水,然后用碱右灰干燥
②K2CO3中混有的少量NaHCO3,可以用加热的方法除去
③乙烯中混有的SO2气体可以通过酸性高锰酸钾溶液除去
④金属铜中含有的少量银和锌可以通过电解精炼的方法除去
⑤H2S中混有的水蒸气用浓硫酸干燥即可
A.①④ B.②③ C.①⑤ D.④⑤
难度: 中等查看答案及解析
-
反兴奋剂是每届体育赛事关注的热点。利尿酸是一种常见的兴奋剂,其分子结构如下: 关于利尿酸的说法中,正确的是
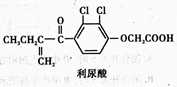
A.它是芳香烃
B.它不能使酸性高锰酸钾溶液褪色
C.它不能与饱和碳酸钠溶液反应放出CO2
D.它能发生取代反应、加成反应和酯化反应
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.大理石溶于醋酸: CaCO3+2H+ =Ca2+ + CO2 ↑ +H2O
B.FeBr2溶液中通入少量的Cl2: Cl2+2Fe2+=2Fe3+ +2Cl-
C.向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42- +Ba2+ +2OH- = BaSO4 ↓+ ↑2H2O
D.酸性氢氧燃料电池的正极反应: H2-2e- = 2H+
难度: 中等查看答案及解析
-
在V mL 0.1 mol/L Na2S溶液中逐滴加入V mL 0. 1 mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是
A.c(SO42-)= c(HS-) =c(K+) >c(OH-)=c(H+)
B.c(Na+)> c(K+)> c(S2-)> c(H+)>c(OH-)
C.c(Na+)= c(S2-)+ c(H2S)+c(HS-)+ c(SO42-)
D.c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-)
难度: 困难查看答案及解析
-
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或 三种元素组成的化合物,辛是由C元素形成的单质。已知:甲+乙=丁 +辛,甲+ 丙=戊+辛;常温下0.1 mol/L 丁溶液的pH为13。下列说法正确的是
A.元素B在周期表中的位置为第二周期第VIA族
B.元素B、C、D的原子半径由大到小的顺序为r (D) > r(C) > r(B)
C.1.0 L0. 1 mol/L戊溶液中阴离子总的物质的量小于0. 1 mol
D.1 mol甲与足量的乙完全反应共转移了约6.02 X 1023个电子
难度: 困难查看答案及解析

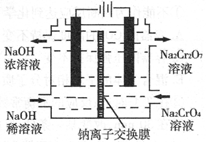
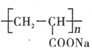 ),聚丙烯酸钠单体的结构简式是________;
),聚丙烯酸钠单体的结构简式是________;