-
生产、生活中处处有化学,下列有关说法正确的是
A. 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料
B. 某雨水样品放置一段时间后,pH由4.68变为4.00,是因为水中溶解的CO2增多
C. 药皂中含有的苯酚具有强氧化性,能杀菌消毒
D. 胶体具有介稳性的主要原因是因胶体粒子所作的布朗运动使它们不容易聚集成质量较大的颗粒而沉降下来
难度: 中等查看答案及解析
-
用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
实验目的
实验方案
所选玻璃仪器
A
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
B
证明CH3COOH与HClO的酸性强弱
相同温度下用pH试纸测定浓度均为0.1mol·L-1 NaClO、CH3COONa溶液的pH
玻璃棒、玻璃片
C
检验蔗糖水解产物具有还原性
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热
试管、烧杯、酒精灯、滴管
D
配制1 L 1.6%的CuSO4溶液(溶液密度近似为1g/mL)
将25g CuSO4·5H2O溶解在975g水中
烧杯、量筒、玻璃棒
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于元素性质说法正确的是
A. Li、C、P分别在氧气中燃烧均能生成两种相应的氧化物
B. 除去CO2中混有的SO2气体可选用Na2SO3溶液或NaHCO3溶液
C. 过量的铁粉与氯气在点燃条件下充分反应,生成氯化亚铁
D. SiO2既可以与氢氟酸反应,又可以与氢氧化钠溶液反应,所以SiO2是两性氧化物
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开
B. 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种
C. 二糖、淀粉、纤维素水解的最终产物都是葡萄糖
D. 芥子醇结构简式是
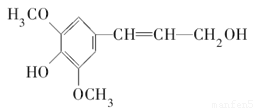 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2
,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2难度: 中等查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1]:
容器
甲
乙
丙
反应物投入量
1 mol N2、3 mol H2
2 mol NH3
4 mol NH3
NH3的浓度(mol·L-1)
c1
c2
c3
反应的能量变化
放出a kJ
吸收b kJ
吸收c kJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
下列说法正确的是
A. 2c1>c3 B. a+b=92.4 C. 2p2<p3 D. α1+α3>1
难度: 困难查看答案及解析
-
25℃时,下列有关电解质溶液的说法错误的是
A. pH=9.25、浓度均为0.1 mol•L-1的NH4C1、NH3·H2O混合溶液:c(NH4+)+c(H+) >c(NH3·H2O)+c(OH-)
B. 0.1mol/LH2SO4溶液与0.1mol/LNaOH溶液等体积混合:c(H+)=c(SO42-)+c(OH-)
C. 向0.1 mol•L-1NaHSO3溶液中通NH3至pH=7: c(Na+)> c(NH4+)>c(SO32-)
D. CO2通入KOH溶液,当由水电离的H+浓度为10-7mol/L,一定存在:c(K+)=2c(CO32-)+c(HCO3-)
难度: 中等查看答案及解析