-
硫及其化合物在生产和生活中都发挥着重要的作用。
(1)SO2是形成酸雨的主要污染物,燃煤脱硫的原理为
2CaO(s)+2SO2(s)+O2(g) 2CaSO4(s)
2CaSO4(s)
向10L恒温恒容密闭容器中加入3mol CaO,并通入2mol SO2和lmol O2发生上述反应,2min时达平衡,此时CaSO4为l.8mol。0〜2min内,用SO2表示的该反应的速率v(SO2)=_________________;其他条件保持不变,若上述反应在恒压条件下进行,达到平衡时SO2的转化率________(“填大”、“减小”或“不变”)。
(2)25℃时,H2SO3的电离常数Kal=1×10-2, Ka2=6×10-8,则该温度下NaHSO3的水解平衡常数Kb=_____________。判断NaHSO3溶液显________性(填“酸”、“碱”或“中”),用简要文字叙述原因是_______________________________。
(3)Na2SO3溶液作为吸收液可脱除烟气中的SO2。•当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
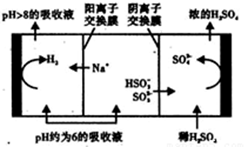
HSO3-在阳极放电时的电极反应式是________________________________。
(4)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g) TaI4(g)+S2(g) △H>0
TaI4(g)+S2(g) △H>0
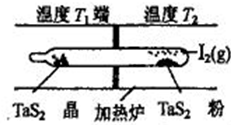
如上图所示,上述反应在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2 (g),—段时间后,在溫度为T1的一端得到了纯净的TaS2晶体,则温度T1 ______T2 (填“>”“<”或“=”)上述反应体系中循环使用的物质是__________________________。
-
煤燃烧排放的烟气含有SO2和NOx,大量排放烟气形成酸雨、污染大气,因此对烟气进行脱硫、脱硝,对环境保护有重要意义。回答下列问题:
Ⅰ.利用CO脱硫
(1)工业生产可利用CO气体从燃煤烟气中脱硫,则25℃时CO从燃煤烟气中脱硫的热化学方程式2CO(g)+SO2(g)⇌2CO2(g)+S(s)的焓变△H=_____________。25℃,100kPa时,由元素最稳定的单质生成1mol纯化合物时的反应热称为标准摩尔生成焓,已知一些物质的“标准摩尔生成焓”如下表所示:
| 物质 | CO(g) | CO2(g) | SO2(g) |
| 标准摩尔生成焓∆fHm(25℃)/kJ∙mol-1 | -110.5 | -393.5 | -296.8 |
(2)在模拟脱硫的实验中,向多个相同的体积恒为2L的密闭容器中分别通入2.2mol CO和1mol SO2气体,在不同条件下进行反应,体系总压强随时间的变化如图所示。
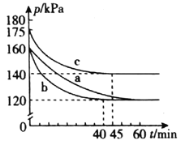
①在实验b中,40 min达到平衡,则0~40 min用SO2表示的平均反应速率v(SO2)=_______。
②与实验a相比,实验b可能改变的条件为_______________,实验c可能改变的条件为_________________。
Ⅱ.利用NH3脱硝
(3)在一定条件下,用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H=-1807.98kJ·mol-1。在刚性容器中,NH3与NO的物质的量之比分别为X、Y、Z(其中X<Y<Z),在不同温度条件下,得到NO脱除率(即NO转化率)曲线如图所示。
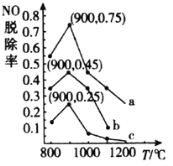
①NH3与NO的物质的量之比为X时对应的曲线为_____________(填“a”“b”或“c”)。
②各曲线中NO脱除率均先升高后降低的原因为__________。
③900℃条件下,设Z= ,初始压强p0,则4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
,初始压强p0,则4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
Ⅲ.利用NaCIO2脱硫脱硝
(4)利用NaClO2的碱性溶液可吸收SO2和NO2(物质的量之比为1:1)的混合气体,自身转化为NaCl,则反应的离子方程式为________________。
-
化学在生产和生活中有着重要的应用。下列叙述中,不正确的是
A.次氯酸钠溶液可用于杀菌消毒
B.推广使用燃煤脱硫技术,防治SO2污染环境
C.纯碱可用于生产普通玻璃,也可用来除去物品表面的油污
D.“辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料
-
化学在生产和日常生活中有着重要的应用,下列说法不正确的是
A. 推广使用燃煤脱硫技术,可以防治SO2的污染
B. 共享单车利用太阳能发电完成卫星定位,有利于节能环保
C. 明矾水解时产生具有吸附性的胶体粒子,可用于水的净化
D. 光导纤维、醋酸纤维、硝酸纤维都是以纤维素为原料的化工产品
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
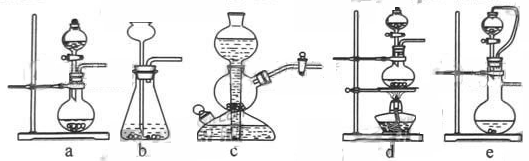
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置
是 ________ (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 ________g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 ________ g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
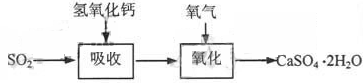
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
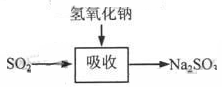
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 ________ 。和碱法相比,石灰-石膏法的优点是 ________ ,缺点是 ________ 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
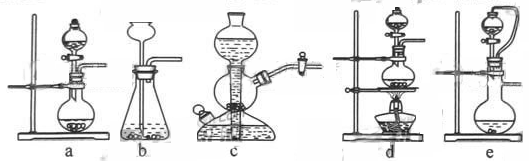
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是________________________________________________________________________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠________________________________________________ g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠________________________________________________________ g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
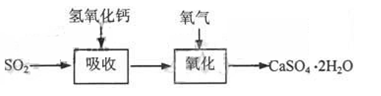
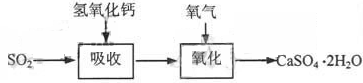
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
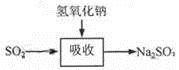
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是________________________________________________________________________________________________________________________________________ 。和碱法相比,石灰-石膏法的优点是________________________________________________________________________________________________________ ,缺点是________________________________________________________________________________________________________________________________ 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
-
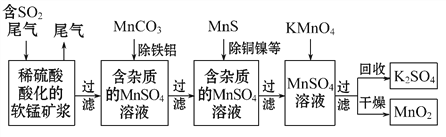
(12分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
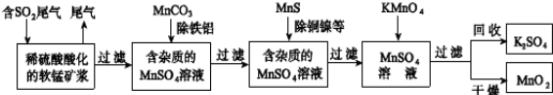
请回答下列问题:
(1)上述流程脱硫实现了 (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)过滤操作用到的玻璃仪器有: 。
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。
(4)写出KMnO4溶液加入到MnSO4溶液中制备MnO2的离子反应方程式: ;用惰性电极电解MnSO4溶液也可制得MnO2,其阳极的电极反应式是 。
(5)MnO2是碱性锌锰电池的电极材料,电池反应方程式为:2MnO2+Zn+H2O====2MnOOH+Zn(OH)2,写出该电池放电时,正极的电极反应式是 。
-
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
下列说法不正确的是( )
A. 上述流程脱硫实现了废弃物的综合利用和酸雨的减少
B. 用MnCO3能除去溶液中Al3+和Fe3+,其原因是碳酸铝和碳酸铁的溶解度比MnCO3更小。
C. MnO2是碱性锌锰电池的正极材料,碱性锌锰电池放电时,正极的电极反应式是MnO2+H2O+e-MnOOH+OH-
D. 假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将am3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为C mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2为(0.6C-0.4ab)mol
-
污染物的有效去除和资源的充分利用是化学造福人类的重要课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料 MnO2(反应条件已省略)。
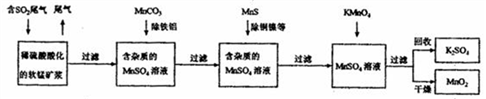
请回答下列问题:
(1)上述流程脱硫实现了____________(选填下列字母编号)。
a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少
(2)KMnO4+MnSO4→MnO2的反应中,氧化剂与还原剂的物质的量之比为____________。
(3)已知:25℃、101kPa 时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)= MnSO4(s) △H=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式为:_______________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2其阳极的电极反应式是__________________________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式为:____________________________________________________。若以该电池为电源,以石墨作电极电解CuSO4溶液,阴极析出铜,阳极产物是___________________。
-
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
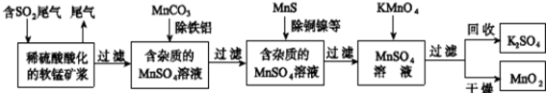
① ② ③ ④ ⑤
请回答下列问题:
(1)上述流程脱硫实现了____________(选填下列字母编号).
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)流程图④过程中发生的主要化学反应的方程式为____________。
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是____________,用MnS除去溶液中的Cu2+的离子方程式为____________。
(4)MnO2可作超级电容器材料。工业上用右图所示装置制备MnO2。接通电源后,A电极的电极反应式为: ____________,当制备1mol MnO2,则膜两侧电解液的质量变化差(△m左-△m右)为________g。
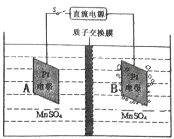
(5)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将am3 (标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为67.2%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2____________kg。
2CaSO4(s)

TaI4(g)+S2(g) △H>0















