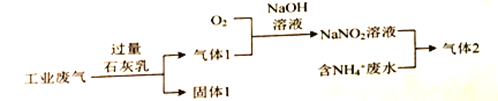
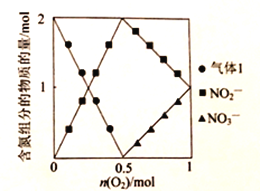
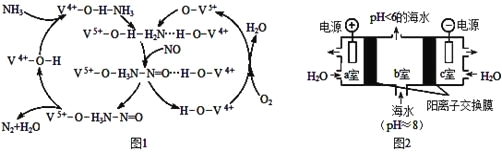
-
化学与人类生产、生活,社会可持续发展密切相关。下列说法正确的是
A.蔬菜表面洒少许福尔马林,可保鲜和消毒
B.推广使用可降解塑料及布质购物袋,以减少“白色污染”
C.绿色食品就是不使用化肥农药,不含任何化学物质的食品
D.推广使用煤液化技术可减少二氧化碳温室气体的排放
难度: 简单查看答案及解析
-
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
A. Kw/c(H+)=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
B. 加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3-
C. c(Fe3+)=0.1mo/L的溶液:NO3-、Al3+、Cl-、CO32-
D. 能使pH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3-
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 重氢原子:13H: B. NH4Br的电子式:
C. 氯原子的结构示意图:
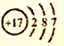 D. 邻羟基苯甲酸的结构简式:
D. 邻羟基苯甲酸的结构简式: 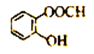
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. 二氧化硅为酸性氧化物,可用于制造光导纤维
B. 铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀
C. 浓硫酸具有脱水性,可用于干燥H2、SO2等
D. Zn具有还原性和导电性,可用作锌锰干电池的负极材料
难度: 中等查看答案及解析
-
下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
a、b、C、d、e为原子序数依次增大的五种短周期元素,其中a、b、c为同一周期相邻元素;b与d的单质在不同条件下可形成两种化合物,但阴阳离子个数比例均为1:2;d、e质子数之和是a的4倍。下列说法正确的是
A. 简单离子半径从大到小:d>a>b>c
B. C单质可从盐溶液中置换出e单质
C. 电解d和e形成的化合物的水溶液可制备e的单质
D. 上述元素形成的氢化物中b的氢化物熔沸点最高
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 向氢氧化钡溶液中加入硫酸氢钠至溶液为中性:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
B. 电解氯化镁溶液:2Cl-+2H2O
H2↑+Cl2↑+2OH-
C. 氯气与水反应:Cl2+H2O==2H++Cl-+ClO-
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-==CaCO3↓+H2O
难度: 困难查看答案及解析
-
下列物质的转化在给定条件下不能实现的是
A. NH3
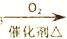 NO
NOHNO3
B. 浓HCl
Cl2
漂白粉
C. Al2O3
AlCl3(aq)
无水AlCl3
Al
D. 淀粉
葡萄糖
C2H5OH
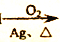 CH3CHO
CH3CHO难度: 中等查看答案及解析
-
通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s)+H2O(g)==CO(g)+H2(g) ΔH1=akJ/mol
②CO(g)+H2O(g)==CO2(g)+H2(g) ΔH2=bkJ/mol
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3=ckJ/mol
④2CH3OH(g)==CH3OCH3(g)+H2O(g) ΔH4=dkJ/mol
A. 反应①、②为反应③提供原料气,且a>0
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)==1/2CH3OCH3(g)+1/2H2O(g)的ΔH=d/2kJ/mol
D. 反应2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)的ΔH=-(2b+2c+d)kJ/mol
难度: 中等查看答案及解析
-
福特公司发明的硫钠电池是一种以金属钠为负极、硫为正极、陶瓷管为电解质隔膜(作用是传递Na+)的二次电池,其原理可以表示为2Na+xS
Na2Sx。现将该电池用于电浮选凝聚法对污水进行处理,电源两极分别连接Fe电极和石墨电极,对污水进行处理后,溶液上层有大量的浮渣。下列有关说法错误的是
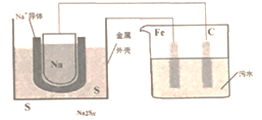
A. 硫钠电池放电时正极反应方程式可表示为:xS+2e-+2Na+=Na2Sx
B. Fe电极为电解池阳极,失电了生成亚铁离子,最终会转化为三价铁形成氢氧化铁胶体从而达到净水目的
C. 处理污水时阴极产生的气体可将水中的悬浮物带到水面形成浮渣层,即浮选凝聚
D. 硫钠电池充电时钠离子向阴极移动,每生成1molNa转移xmol电子
难度: 中等查看答案及解析
-
已知常温下CH3COOH和NH3·H2O的电离平衡常数分别为Ka、Kb。若在常温下向0.1mol/L的醋酸溶液中逐滴加入相同浓度的氨水直至完全过量,则下列说法正确的是
A. 加入氨水的过程中,溶液的导电性一直不断增强
B. CH3COONH4在水溶液中的水解平衡常数Kh=Kw/(Ka+Kb)
C. 若Ka≈Kb,当加入等体积的氨水时,溶液基本呈中性
D. 该等式在滴加过程中始终成立c(CH3COO-)+c(CH3COOH)=c(NH4+)+c(NH3·H2O)
难度: 困难查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向硅酸钠溶液中滴加盐酸
有白色胶状沉淀生成
非金属性:C1>Si
B
向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中
生成白色沉淀
溶液X中一定含有CO32-或HCO3-
C
蔗糖溶液在硫酸存在下加热一段时间后,再与银氨溶液混合水浴加热
无银镜出现
蔗糖没有水解
D
向鸡蛋白溶液中滴入HgCl2溶液
有白色沉淀
蛋白质发生盐析
A. A B. B C. C D. D
难度: 中等查看答案及解析
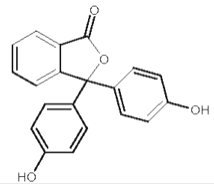

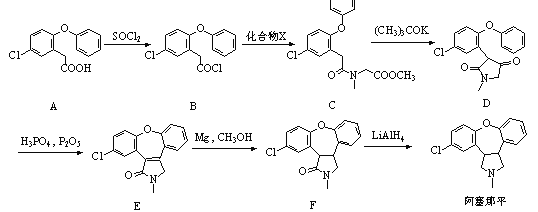
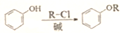 ,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、CH3NH2和
,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、CH3NH2和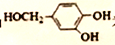 为原料制备
为原料制备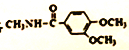 的合成路线流程图(无机试剂任用)。_____________
的合成路线流程图(无机试剂任用)。_____________