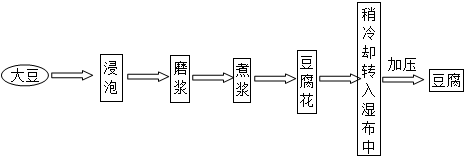
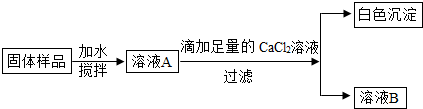
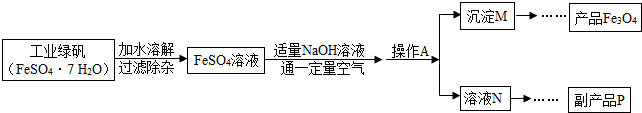
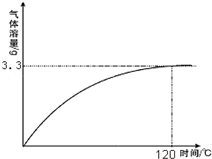
-
小军同学在做家庭小实验时.向热的大米粥中加入碘酒,发现未变蓝色.面对“异常”现象,他不应该采取的做法是( )
A.向老师请教
B.查找相关资料,探究原因
C.反复实验.并观察是否有相同现象
D.认为自己做错了,继续做其它实验难度: 中等查看答案及解析
-
下列物质间的转化,不能一步实现的是( )
A.MgCl2→Mg
B.O2→H2O
C.H2SO4→HCl
D.NaNO3→NaCl难度: 中等查看答案及解析
-
“关爱生命,拥抱健康”是永恒的主题.下列做法不利于人体健康的是( )
A.多食水果和蔬菜,给人体补充维生素
B.向易变质的食品包装袋中充人氮气
C.胃酸过多的病人应少喝汽水
D.用甲醛浸泡水产品,以防其变质难度: 中等查看答案及解析
-
由于森林的过量砍伐、草场大面积开垦,土地出现沙漠化,导致我市今年出现了近几年来最严重的沙尘暴天气.沙尘暴天气使空气中增加了大量的( )
A.可吸入颗粒物
B.一氧化碳
C.二氧化氮
D.二氧化硫难度: 中等查看答案及解析
-
下列对相应现象或事实的解释不正确的是( )
选项 现象或事实 解 释 A 金刚石和石墨的性质差异较大 两者的原子排列方式不同 B 酒香不怕巷子深 分子不断的运动 C 坏血病和骨质疏松症 都是因为缺钙 D 用铁、铝制作炊具;用干冰进行人工降雨;用铜制作导线 都是利用物质的物理性质
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
燃烧固体燃料需要架空,燃烧才能更旺.从燃烧的条件看,燃料架空的实质是( )
A.增大可燃物的热值
B.提高空气中氧气的含量
C.提高可燃物的着火点
D.增大可燃物与空气的接触面积难度: 中等查看答案及解析
-
下列物质的用途,主要利用其物理性质的是( )
A.
压缩天然气做燃料
B.
金属铜用于制导线
C.
氮气用于食品防腐
D.
石灰中和酸性土壤难度: 中等查看答案及解析
-
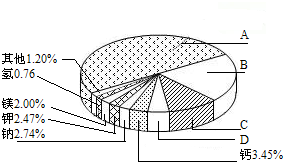
如图所示为某阳离子的结构示意图,则x的数值可能是( )
A.9
B.10
C.12
D.17难度: 中等查看答案及解析
-
一些食物的近似pH如图所示.对于胃酸过多的人,空腹时最宜进食的( )

A.苹果
B.葡萄
C.牛奶
D.玉米粥难度: 中等查看答案及解析
-
图表资料可以为我们提供很多信息.下列从图表中获取的信息及应用不正确的是( )
A.根据金属的熔点数据表.可判断金属的导电性强弱
B.根据金属活动性顺序表,可判断金属是否容易被盐酸腐蚀
C.根据元素周期表,可查找元素的原子序数、元素符号、相对原子质量等信息
D.根据空气质量报告,可知道空气质级别和首要污染物难度: 中等查看答案及解析
-
规范实验操作是获得实验成功的重要保证.下列化学实验操作正确的是( )
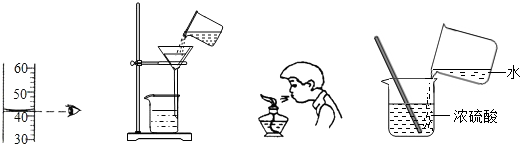
A.读出液体的体积
B.过滤
C.熄灭酒精灯
D.稀释浓硫酸难度: 中等查看答案及解析
-
如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
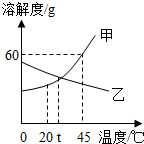
A.甲物质的溶解度为60g
B.t℃时,甲、乙两物质的溶解度相等
C.升高温度可使不饱和的甲溶液变为饱和
D.乙物质的溶解度随温度的升高而增大难度: 中等查看答案及解析
-
类推的思维方法在化学学种应用广泛,例如:
 由此推断,过氧化钡的化学式为( )
由此推断,过氧化钡的化学式为( )
A.Ba2O
B.BaO2
C.Ba2O2
D.BaO3难度: 中等查看答案及解析
-
在化学反应2A+B2=2AB中,A 与B2反应的质量关系如图所示,现将6g A和8g B2充分反应,则生成AB的质量是( )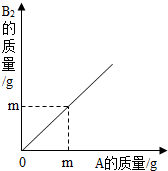
A.9g
B.11g
C.12g
D.14g难度: 中等查看答案及解析
-
对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A B C D 实
验
装
置
硫在氧气中燃烧
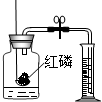
测定空气中氧气含量
铁丝在氧气中燃烧
探究燃烧的条件解释 集气瓶中的水:吸收放出的热量 量筒中的水:通过水体积的变化得出O2体积 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 烧杯中的水:加热铜
片;隔绝空气
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
用氯化钠固体配制100g质量分数为5%的氯化钠溶液.下列仪器中必需用到的是( )
① ② ③ ④ ⑤ ⑥ ⑦ 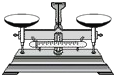
A.②④⑥⑦
B.①④⑤⑥
C.①③⑤⑦
D.①②④⑦难度: 中等查看答案及解析
-
葡萄糖、乙酸(CH3COOH)和尿素[CO(NH2)2]组成的混合物240g,在一定条件下完全燃烧,生成水的质量是( )
A.48g
B.72g
C.144g
D.无法计算难度: 中等查看答案及解析