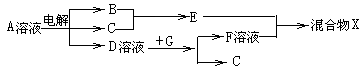
-
下列化学用语表达正确的是( )
A.HF的电子式为:
B.HClO的结构式:H-Cl-O
C.质子数为92、中子数为146的U原子:
D.Cl-的结构示意图:

难度: 中等查看答案及解析
-
元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满。若发现119号元素,请在“元素大厦”中安排好它的“房间”( )
A.第七周期0族 B.第六周期第ⅡA族 C.第八周期第ⅠA族 D.第七周期第ⅦA族
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是( )
A.钠与冷水的反应 B.甲烷在氧气中的燃烧反应
C.灼热的木炭与CO2反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
难度: 中等查看答案及解析
-
元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
难度: 中等查看答案及解析
-
是( )
A.氧元素的五种不同微粒 B.五种氧元素
C.氧的五种同素异形体 D.氧的五种同位素
难度: 简单查看答案及解析
-
下列有关原子结构、元素性质的说法正确的是( )
A.Si、P、S、Cl元素的单质与氢气化合越来越容易
B.元素原子最外层电子数越多,元素金属性越强
C.元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族
D.F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小
难度: 中等查看答案及解析
-
下列物质中不含非极性共价键的是:①Na2O2 ②CCl4 ③O2 ④NH4Cl ⑤H2O2 ⑥Ca(OH)2 ( )
A.①②③④ B.④⑤⑥ C.②④⑥ D.②③⑤
难度: 中等查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( )

A.物质的量之比为2:3 B.质量之比为2:3
C.摩尔质量之比为2:3 D.反应速率之比为3:2
难度: 中等查看答案及解析
-
下列叙述中,能肯定A金属比B金属活泼性强的是( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子的电子层数多
C.1 molA从酸中置换出的H2比1 molB从酸中置换出的氢气多
D.常温时,A能从水中置换出氢气而B不能
难度: 中等查看答案及解析
-
某元素原子最外层上只有两个电子,该元素( )
A.一定是金属元素 B.一定能和氢氧化钠溶液反应生成氢气
C.一定是ⅡA族元素 D.可能是金属元素,也可能不是金属元素
难度: 中等查看答案及解析
-
某一周期的第ⅡA族元素的原子序数为Z,那么同一周期的第ⅢA族元素的原子序数( )
A.可能是Z+1或Z+11或Z+25 B.只有Z+1
C.可能是Z+1或Z+11 D.可能是Z+2或Z+8或Z+18
难度: 中等查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如图所示.已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍.则A、B、C分别是( )
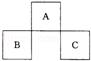
A.C、Al、P B.N、Si、S C.0、P、Cl D.F、S、Ar
难度: 中等查看答案及解析
-
某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含质子的物质的量是( )
A.
(A+N+m)mol B.
(A-N)mol
C.
(A-N)mol D.
(A-N+m)mol
难度: 困难查看答案及解析
-
已知aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
A.原子半径:A>B>C>D B.原子序数:b>a>c>d
C.离子半径:D>C>B>A D.失电子能力:B>A,得电子能力:D>C
难度: 中等查看答案及解析
-
短周期元素A、B可形成A3B2型化合物,若B的原子序数为 b,则A的原子序数不可能为( )
A.b-3 B.b+5 C.b+4 D.b一11
难度: 中等查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
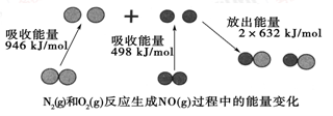
下列说法中正确的是
A.1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
难度: 中等查看答案及解析