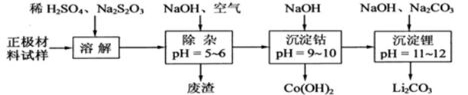
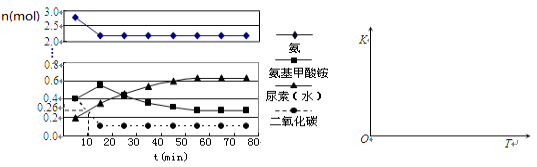
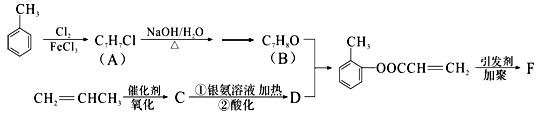
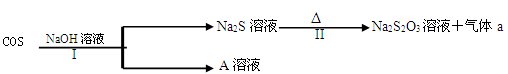-
化学与环境保护、工业生产、生活等密切相关。下列说法正确的是
A.使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容
B.食盐、食醋、食用油均可用作食品添加剂,都属于有机物
C.碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用
D.石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化
难度: 简单查看答案及解析
-
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比为l:l:6。下列有关该溶液的判断正确的是
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中滴加稀NaOH溶液,立即出现白色沉淀
C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为l
D.向该溶液中加入过量铁粉,只发生置换反应
难度: 困难查看答案及解析
-
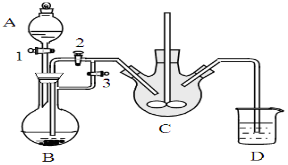
对下列装置图的叙述正确的是
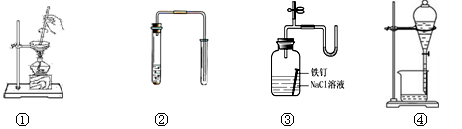
A.装置①可用于加热蒸干氯化铵溶液得到氯化铵晶体
B.装置②可用于铜和稀硝酸制取并收集少量NO
C.装置③可用于证明铁生锈氧气参与反应
D.苯萃取碘水中的碘后,从装置④下口放出的是碘的苯溶液
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 mol CH3+(碳正离子)中含有质子数为8NA
B.6.4gCu与足量的硫反应,转移电子数为0.2 NA
C.标准状况下,将分子总数为NA的NH3和HCl的充分混合后,所得混合气体体积越为22.4L
D.7.8 g Na2O2中含有的离子总数目为0.3NA
难度: 困难查看答案及解析
-
已知咖啡酸的结构如右图所示。关于咖啡酸的描述正确的是
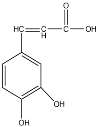
A.与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物可能的结构只有2种
B.与溴水既能发生取代反应,又能发生加成反应
C.1mol咖啡酸最多可与5mol氢气发生加成反应
D.能与Na2CO3溶液反应,但不能与NaHCO3溶液反应
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。Z原子的最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍。X与Y、Z位于相邻的周期。下列说法正确的是
A.X的最高价氧化物对应的水化物是弱酸
B.Z位于元素周期表的第3周期第ⅥA族
C.Y的最高氧化物对应的水化物能溶于NaOH溶液
D.原子半径的大小顺序:r(Z)>r(Y)>r(X)
难度: 中等查看答案及解析
-
如上右图装置可用于收集气体并验证其某些化学性质,下列相关的选项正确的是
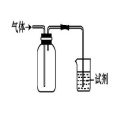
选项
气体
试剂
现象
结论
A
NH3
酚酞试液
溶液变红色
NH3的水溶液显碱性
B
SO2
酸性KMnO4溶液
溶液褪色
SO2具有漂白性
C
HCl
硅酸钠溶液
生成白色沉淀
Cl的非金属性比Si强
D
X
KI淀粉溶液
溶液变蓝
X可能是Cl2
难度: 中等查看答案及解析