-
根据热化学方程式(在101kPa时):S(s)+02(g)==SO2(g);△H=-297.23kJ/mol,分析下列说法中不正确的是
A.1mol S完全燃烧时放出的热量为297.23kJ
B.S(g)+O2(g)=SO2(g)放出的热量大于297.23kJ
C.S(g)+O2(g)=SO2(g)放出的热量小于297.23KJ
D.形成1mol SO2的化学键所释放的总能量大于断裂lmol S(s)和1mol O2(g)的化学键所吸收的总能量
难度: 简单查看答案及解析
-
有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化;如果把Cu浸入c的盐溶液里,有c的单质析出。据此判断它们的活动性由强到弱的顺序是( )
A.d、c、a、b B.d、b、a、c C.d、a、b、c D.b、a、d、c
难度: 中等查看答案及解析
-
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式书写正确的是
A.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.52 kJ·mol-1
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=+1451.52 kJ·mol-1
难度: 中等查看答案及解析
-
自瑞士ETH天文研究所的Ansgar Grimberg等的研究结果表明,太阳气体中存在大量的20Ne和22Ne。下列关于20Ne和22Ne的说法正确的是
A.20Ne和22Ne互为同位素 B.20Ne和22Ne是同一种核素
C.20Ne的原子核中有20个质子 D.22Ne的原子核中有22个中子
难度: 简单查看答案及解析
-
类比推理是化学中常用的思维方法。下列推理正确的是
A.CO2是直线型分子,推测CS2也是直线型分子
B.SiH4的沸点高于CH4,推测H2Se的沸点高于H2O
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D.NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr
难度: 中等查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
难度: 中等查看答案及解析
-
下列食品添加剂中,其使用目的与反应速率有关的是( )
A.抗氧化剂 B.调味剂 C.着色剂 D.增稠剂
难度: 简单查看答案及解析
-
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g) ⇌C(g)+D(g)已达平衡的是( )
A. 混合气体的压强 B. 混合气体的密度
C. B的物质的量浓度 D. 混合气体的平均相对分子质量
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
A. Al在氧气中燃烧生成Al2O3,将铝粉改为铝片
B. Fe与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸
C. Zn与稀硫酸反应时,适当提高溶液的温度
D. Na与水反应时增大水的用量
难度: 中等查看答案及解析
-
下列晶体中,化学键种类相同、晶体类型也相同的是( )
A. SO3与SiO2 B. NO2与H2O C. NaCl与HCl D. CCl4与KCl
难度: 中等查看答案及解析
-
下列说法中正确的是 ( )
A. 元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化
B. 元素性质的周期性变化决定于元素原子核外电子排布的周期性变化
C. 从Li―→F,Na―→Cl,元素的最高化合价均呈现从+1价―→+7价的变化
D. 电子层数相同的原子核外电子排布,其最外层电子数均从1个到8个呈现周期性变化
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)===2C(g)+D(g)经2 min,B的浓度减少0.6 mol·L-1。对此反应的化学反应速率的正确表示是( )
A. 用A表示的反应速率是0.4 mol·(L·min)-1
B. 用B表示的反应速率是0.005 mol·(L·s)-1
C. 在2 min末的反应速率,用B表示是0.3 mol·(L·min)-1
D. 在这2 min内B和C两物质浓度都逐渐减小
难度: 中等查看答案及解析
-
4P(红磷,s)⇌P4(白磷,s) ΔH=+17 kJ·mol-1,根据以上热化学方程式,下列推论正确的是( )
A. 当1 mol白磷完全转变成红磷时放出17 kJ热量
B. 正反应是一个放热反应
C. 当4 g红磷转变成白磷时吸收17 kJ热量
D. 白磷比红磷稳定
难度: 中等查看答案及解析
-
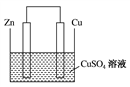
将纯锌片和纯铜片插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是( )

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯的溶液中H+ 浓度均减小
D.乙装置中化学能转化为电能
难度: 简单查看答案及解析
-
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,下列说法错误的是( )
A. 水既是氧化剂又是溶剂 B. 放电时正极上有氢气生成
C. 放电时OH-向正极移动 D. 总反应为2Li+2H2O===2LiOH+H2↑
难度: 中等查看答案及解析
-
甲~庚等元素在周期表中的相对位置如表所示,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )

A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应、
D. 丁的单质可用于制造光导纤维
难度: 中等查看答案及解析
-
将下列晶体熔化:硫酸、二氧化硅、氧化铝、氯化铝,需要克服的微粒间的相互作用①共价键、②离子键、③分子间作用力,正确的顺序是( )
A. ①②②③ B. ③①②③ C. ②③②① D. ①①②③
难度: 中等查看答案及解析
-
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个。则这三种元素所组成的化合物的分子式不可能是( )
A. X2YZ4 B. XYZ3 C. X3YZ4 D. X4Y2Z7
难度: 简单查看答案及解析
-
在恒温、恒容条件下,不能表示H2(g)+I2(g)
2HI(g)达到化学平衡状态的是( )
A. 单位时间内消耗a mol H2的同时消耗2a mol HI
B. 容器内的总压强不随时间变化
C. 容器内H2、I2不再减少,HI不再增加
D. 混合气体的颜色不再发生变化
难度: 中等查看答案及解析
-
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol H2中的化学键消耗的能量为Q1 kJ,破坏1 mol Cl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学键释放的能量为Q3 kJ。下列关系中,正确的是
A.Q1+Q2>Q3 B.Q1+Q2>2Q3
C.Q1+Q2<Q3 D.Q1+Q2<2Q3
难度: 中等查看答案及解析
-
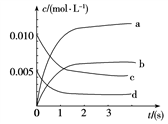
一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如右图所示,对该反应的推断合理的是( )

A.该反应的化学方程式为3B+4D
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
难度: 中等查看答案及解析
-
在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4 s时测得各物质的浓度如表,则下列判断正确的是( )
测定时刻/s
浓度
t1
t2
t3
t4
c(A)/(mol·L-1)
6
3
2
2
c(B)/(mol·L-1)
5
3.5
3
3
c(C)/(mol·L-1)
1
2.5
3
3
A. 在t3 s时反应已经停止
B. t3~t4 s内正、逆反应速率不相等
C. 在容器中发生的反应为A(g)+B(g) ⇌C(g)
D. 在t2~t3 s内A的平均反应速率为
mol/(L·s)
难度: 中等查看答案及解析
-
下列比较金属性相对强弱的方法或依据正确的是( )
A. 根据金属失电子的多少来确定,失电子较多的金属性较强
B. 用钠来置换MgCl2溶液中的Mg,可验证钠的金属性强于Mg
C. 根据Mg和Al与水反应的剧烈程度来比较它们的金属性强弱
D. 根据碱性:NaOH>Mg(OH)2>Al(OH)3,可说明钠、镁、铝的金属性依次减弱
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 气态氢化物RH3比气态氢化物HM稳定,表明非金属性R>M
B. 等物质的量的单质A和单质B跟足量的酸反应,A放出H2多,则金属性A>B
C. 含Q的酸比含N的酸的酸性强,则非金属性Q>N
D. 单质Y跟水反应比单质X与水反应剧烈,则金属性Y>X
难度: 中等查看答案及解析