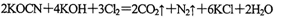-
下列分散系属于胶体的是
A.稀豆浆 B.FeCl3溶液 C.碘酒 D.食盐水
难度: 简单查看答案及解析
-
下列试剂中,标签上应标注下图的是
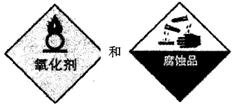
A C2H50H. B.HNO3 C.NaOH D.HCl
难度: 简单查看答案及解析
-
下列物质中属于电解质的是
A.二氧化碳 B.乙醇 C.铜 D.硝酸钾
难度: 简单查看答案及解析
-
下列说法正确的是
A.O2的摩尔质量是32
B.摩尔是物质的量的单位
C.1 mol任何物质都约含有6.02x10
个原子
D.物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4
(
表示阿伏加德罗常数的值)
难度: 简单查看答案及解析
-
采用不同的分类方法,可将非金属氧化物分为不同的类型。例如从某种意义上可将P2O5、SO2、SO3 、Cl2O7等归为—类,则下列氧化物与它们属于同—类的是
A.CO B.NO C.N2O5 D.Na20
难度: 简单查看答案及解析
-
下列实验中,所采用的分离或提纯与对应原理都正确的是
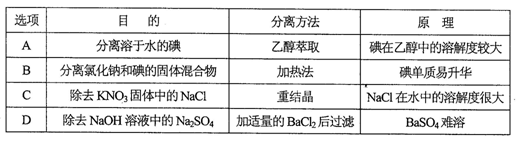
难度: 简单查看答案及解析
-
下列叙述不正确的是
A.除去镁粉中少量的铝粉,加足量氢氧化钠溶液反应后,过滤
B.做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸
C.金属钠可以保存在煤油里
D.可用过滤的方法除去氢氧化铁胶体中的氯化铁溶液
难度: 简单查看答案及解析
-
下列物质所含分子(或溶质分子)数最多的是
A.4gH2
B.l00mL质量分数为98%,密度为1.84g/
的浓硫酸
C.1.5x10
个N2
D.标准状况下33.6L O2
难度: 简单查看答案及解析
-
下列化学反应中,铁元素被氧化的是
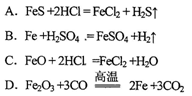
难度: 简单查看答案及解析
-
下列化学反应中,不能产生氢气的是
A.红热的铁与水蒸气 B.铁与稀硝酸反应
C.铝和NaOH溶液反应 D.钠与水反应
难度: 简单查看答案及解析
-
不能用离子方程式:
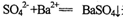 来表示的该反应的化学方程式是
来表示的该反应的化学方程式是A.硝酸钡溶液与稀硫酸
B.稀硫酸与氯化钡溶液反应
C.碳酸钡与稀硫酸
D.氯化钡溶液与硫酸钠溶液
难度: 简单查看答案及解析
-
下列说法不正确的是
A.金属钠着火时,用细沙覆盖灭火
B.Na的化掌性质比镁活泼,故用Na与MgCl2溶液反应制取金属镁
C.金属钠与氧气反应,条件不同,产物不同
D.9.2g金属钠与足量水反应,反应过程中有0.4mol电子转移
难度: 简单查看答案及解析
-
下列化学反应的离子方程式书写不正确的是
A.碳酸钙与盐酸的反应:
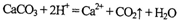
B.等物质的量的
和HCl溶液混合:
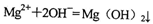
C.氧化铜与稀H2SO4反应:
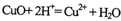
D.金属钠跟水反应
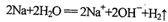
难度: 中等查看答案及解析
-
等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液中SO42-的物质的量浓度比为
A.1:2:3 B.1:6:9 c.1:3:3 D.1:3:6
难度: 中等查看答案及解析
-
对下列实验过程的评价,正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B.用Ba(NO3)2溶液鉴别Cl-、SO42-、C032-
C.检验某溶液中是否含有SO42-时,应取少量的该溶液,依次加入BaCl2和稀盐酸
D.验证某溶液中是否含Cl-,先加入过量的稀硝酸,再加入AgNO3溶液,有白色沉淀,则证明含Cl-
难度: 简单查看答案及解析
-
某无色溶液中加入铝片可以生成氢气,则该溶液中一定能大量共存的离子组是

难度: 中等查看答案及解析
-
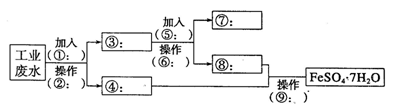
茶叶中铁元素的检验可经过以下四个步骤完成各步骤中选用的实验用品不能都用到的是(Fe3+的检验滴加KSCN溶液)
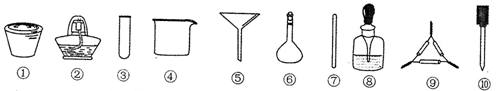
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到的滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用⑨、⑧和⑩
难度: 简单查看答案及解析
-
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
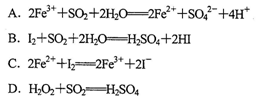
难度: 中等查看答案及解析
-
钠在干燥空气中形成的氧化物0.70g,溶于水后,可被100g质量分数为0.73%的盐酸恰好中和,钠的氧化物的成分是
A.Na2O2和Na2O B.Na2O C.Na2O2 D.无法确定
难度: 中等查看答案及解析
-
设
为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3
B.2 L0.5 mol
硫酸钾溶液中阴离子所带电荷数为
C.C2H4和N2组成的42g混合气体中原子的个数为3
D.
 反应中,生成28gN2 时,转移的电子数目为3.75
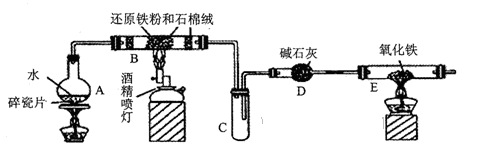
反应中,生成28gN2 时,转移的电子数目为3.75难度: 中等查看答案及解析
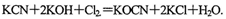 该反应中,被氧化的元素是___________.
该反应中,被氧化的元素是___________.