-
下列关于元素周期表的第三周期元素叙述错误的是 ( )
A. 从左到右,原子半径逐渐减小,元素的金属性逐渐减弱
B. 元素最高价氧化物对应的水化物中,酸性最强的是HClO4
C. 均为主族元素
D. 原子的核外电子层数均为3
难度: 简单查看答案及解析
-
下列说法,错误的是 ( )
A. 化学变化中的能量变化主要是由化学键变化引起的
B. 物质发生化学反应时不一定伴随着能量变化
C. 化学反应中能量变化的大小与反应物质的质量有关
D. 化学反应中的能量变化,通常主要表现为热量的变化
难度: 简单查看答案及解析
-
某反应的生成物Y的浓度在4min内由0变成了4mol/L,则以Y表示该反应在4min内的平均反应速率为 ( )
A. 16 mol/(L·min) B. 4 mol/(L·min)
C. 2 mol/(L·min) D. 1 mol/(L·min)
难度: 简单查看答案及解析
-
下列装置中能够形成原电池的是( )
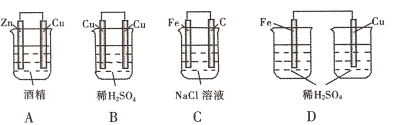
难度: 简单查看答案及解析
-
下列关于甲烷的说法错误的是( )
A. 与氯乙烷是同系物 B. 属于饱和烃
C. 是共价化合物 D. 能与卤素单质发生取代反应
难度: 简单查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法正确的是( )
A. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B. 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,但与氯气不同的是不产生有机氯对人体造成危害
C. 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,也属于离子化合物,其阴阳离子个数比为1∶1
D. 氢氧燃料电池是一种能量转换率较高、符合绿色化学理念的新型动力能源,能量转化率可达到100%
难度: 中等查看答案及解析
-
2018年1月复旦大学魏大程团队在石墨烯量子点研究领域取得重要进展。该项研究在未来光学和光电器件方面具有巨大潜力。下面有关碳的叙述正确的是( )
A. 石墨与C60互为同位素 B. 13C与14C是两种不同的原子
C. 金刚石是碳元素的一种核素 D. 14C的原子核内有2个中子
难度: 简单查看答案及解析
-
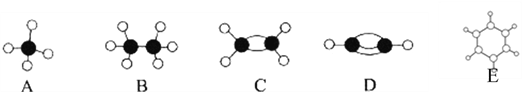
下列化学用语正确的是( )
A. HClO的结构式:H-O-Cl B. H2O2的电子式:
C. 甲烷分子的球棍模型:
 D. 14N 的原子结构示意图:
D. 14N 的原子结构示意图: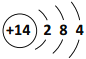
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A. H2和D2互为同位素
B. H2N—CH2—COOH和H3C—CH2—NO2互为同分异构体
C. 正丁烷、异丁烷、戊烷沸点依次增大
D. Fe2+和Fe3+互为同素异形体
难度: 简单查看答案及解析
-
假设某化学反应的反应过程如下图所示。观察分析,符合图中变化的化学反应为( )
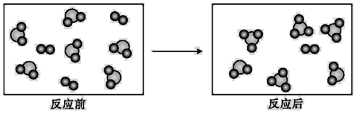
A. A2+3B2=2AB3 B. 2AB2+B2=2AB3 C. 2A2B+5B2
4AB3 D. 2AB2+B2
2AB3
难度: 简单查看答案及解析
-
下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项 ( )
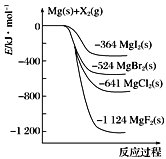
①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④常温下氧化性:F2<Cl2<Br2<I2
A. 1项 B. 2项
C. 3项 D. 4项
难度: 中等查看答案及解析
-
H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是

A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B. 图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越慢
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,c(Mn2+)对H2O2分解速率的影响大
难度: 中等查看答案及解析
-
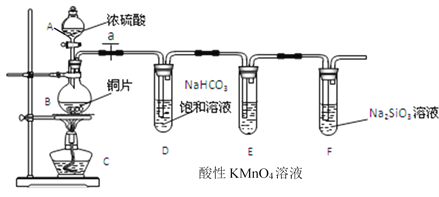
下列实验操作中正确的是( )
A. 利用酸性高锰酸钾溶液除甲烷中的少量乙烯
B. 制取溴苯:将铁屑、溴水、苯混合加热
C. 制纯净的氯乙烷:等物质的量的氯气与乙烷光照条件下发生反应
D. 通过向溴水中加入己烷来萃取溴水中的溴
难度: 简单查看答案及解析
-
根据下表信息,判断以下叙述正确的是( )
短周期元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 简单离子半径L>T B. 单质与稀盐酸反应的剧烈程度为L<Q
C. 氢化物的热稳定性为H2T<H2R D. 氢化物的沸点为H2T>H2R
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. H与O可形成既含极性共价键又含非极性共价键的化合物
B. 28g由 C2H4和 C3H6组成的混合物中,H原子的数目为4NA
C. 在D218O中,质量数之和是质子数之和的两倍
D. 1mol —CH3中含有的电子数为9NA
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
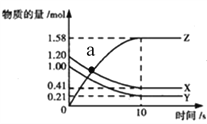
A. 反应的化学方程式为X(g)+Y(g)===Z(g)
B. a点正、逆反应速率相等
C. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
D. 反应开始到10s,Y转化率为79%
难度: 简单查看答案及解析
-
在容积固定容器中,发生反应2HI(g)
H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
①混合气体的颜色不再变化 ②
各组分浓度相等 ③
④一个H-H键断裂的同时有两个H-I 键断裂 ⑤混合气体的平均摩尔质量不再变化
A. ①④ B. ①②④ C. ①③⑤ D. ①④⑤
难度: 中等查看答案及解析
-
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
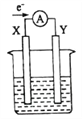
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
难度: 简单查看答案及解析
-
某烃的结构简式为
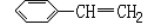 ,下列对它的描述正确的是( )
,下列对它的描述正确的是( )A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 所有原子可能共平面
C. 易溶于水,也易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成
难度: 简单查看答案及解析
-
两种气态烃按一定比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中一定不符合此条件的是( )
A. CH4 C3H6 B. CH4 C2H4
C. C2H4 C3H4 D. C2H2 C3H6
难度: 中等查看答案及解析