-
下列叙述不正确的是
A. 氟利昂(CCl2F2)因破坏大气臭氧层而导致“温室效应”
B. 提倡人们购物时不用塑料袋,是为了防止白色污染
C. 北京奥运会开幕式上的“脚印”焰火主要是利用了焰色反应的有关知识
D. 为防止电池中的重金届等污染土壤和水体,应积极开发废电池的综合利用技术
难度: 中等查看答案及解析
-
下列物质中的杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是
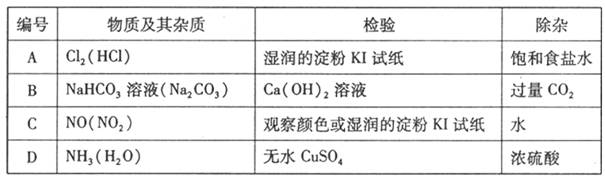
难度: 中等查看答案及解析
-
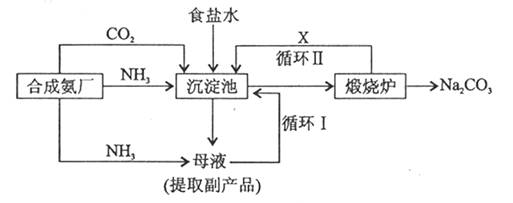
多硫化钠
在NaOH溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16。Na2Sx在结构上与Na2O2类似。则下列有关说法正确的是
A. Na2Sx中的X数值为2
B. 1 molNa2Sx参加反应,有32mol电子转移
C. Na2Sx含有离子键和极性共价键
D. 该反应中Na2Sx是氧化剂,NaClO是还原剂
难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是

难度: 中等查看答案及解析
-
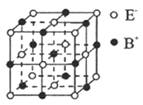
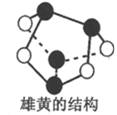
NA表示阿伏加德罗常数的值,下列说法正确的是
A. 250C时,pH=2的1.0L H2SO4溶液中含有的H+数目为0.02NA
B. 0.5mol雄黄(,结构如右图)含有NA个S - S键
C. 将含有lmolFeCl3溶质的饱和溶液加人沸水中可以得到1 mol Fe(OH)3胶粒
D. 向含有FeI2的溶液中通入适蛩氣气,当有1molFe2+被氧化时,该反应转移电子的数目至少为3NA
难度: 中等查看答案及解析
-
某无色气体可能含HCl、HBr、S02、C02中的一种或几种。将该气体通入到适量氯水中,恰好完全反应,不再剩余气体。将所得到的无色溶液分别装在两支试管中,分别加人酸化的AgNO3溶液、酸化的BaCl2溶液,均只产生白色沉淀。则下列判断正确的是
A.原气体中一定有HCl
B.原气体中一定有SO2,—定没有HBr
C.原气体中可能有SO2
D.不能确定有无HCl和HBr,但一定没有CO2
难度: 中等查看答案及解析
-
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如右下图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素。下列说法错误的是


难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是

难度: 中等查看答案及解析
-
利用右图所示的装置,当X、Y选用不同材料,开关K1,与K2处于不同的闭合状态时,可将该装置广泛应用于工业生产。下列说法中正确
的是
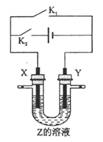
A. 若关闭K2,打开K1,X、Y均为石墨,Z是NaCl,则X附近能得到氢氧化钠
B. 若关闭K2,打开K1,X是纯铜,Y是粗铜,Z是CuSO4 ,该装置可用于铜的楮炼
C. 若关闭K1,打开K2,X是Cu铜,Y是是H2SO4,则溶液中的
移向Y极
D. 若关闭K1,打开K2,X是Cu铜,Y是Fe,Z是含有空气的海水,该装置可用于保护Fe
难度: 中等查看答案及解析
-
下列溶液中微粒浓度关系一定正确的是

难度: 中等查看答案及解析
-
恒压密闭容器中充入2molX和5molY,发生反应:
,温度分别为T1和T2时,X的转化率
随时间变化的关系如右图所示。则下列结论正确的是
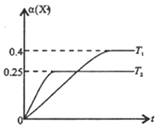
A. 达到平衡后,其它条件不变,降低温度,
均减小,Y的转化率
也减小
B. 达到平衡后,其它条件不变,通入稀有气体或者增加M,平衡均向逆反应方向移动
C. 当温度为T2时,若开始加人1 mol X,2mol Y ,2 mol Z和1mol M,达到平衡后乙的体积分数约为16.7%
D. 当温度为T1时,若开始加入1molX、2mol Y、2 mol Z和a mol M,达到平衡后若X、Y、Z的物质的量分数与原平衡保持不变,则应满足:
难度: 中等查看答案及解析
-
将5.52gFeOJe2O3、CnO的混合物加入120mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液40mL;将等质量的原混合物用CO气体加热还原,则在该实验过程中CO失去电子的物质的量不可能是
A. 0.06mol B. 0.12mol C. 0.18mol D. 0.20mol
难度: 中等查看答案及解析