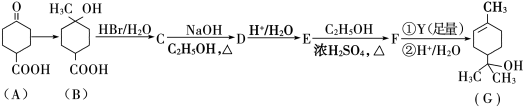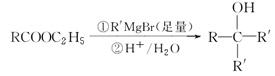-
化学与生活、生产密切相关,下列有关叙述正确的是
A.氢氧化铝、小苏打、纯碱均可用作胃酸中和剂
B.古代的陶瓷、水泥、石英玻璃等,都是硅酸盐产品
C.将草木灰(含K2CO3)与NH4Cl混合使用会降低肥效
D.石油的分馏、煤的干馏等物理变化在生产中有着重要的地位
难度: 简单查看答案及解析
-
设NA为阿伏加罗常数的值,下列说法正确的是
A.298K 101kPa时,22.4L CO2所含的原子数为3NA
B.1mol Cl2与足量的Fe完全反应,转移的电子数为2NA
C.0.5mol C2H2和C6H6的气态混合物中所含原子总数为2NA
D.2L 1mol/L的盐酸中所含HCl分子数约为2NA
难度: 中等查看答案及解析
-
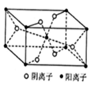
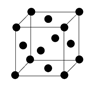
下列离子方程式或化学方程式正确的是
A.粗硅的制取:SiO2+C
Si+CO2↑
B.赤铁矿与稀盐酸的反应:Fe3O4+8H+ = Fe2++2Fe3++4H2O
C.向Ba(OH)2溶液加入过量NaHCO3溶液:2HCO3— + Ba2+ + 2OH— = BaCO3↓+2H2O +CO32-
D.向烧碱溶液中通入氯气可制取漂白粉:Cl2+2NaOH=NaCl+NaClO+H2O
难度: 中等查看答案及解析
-
下列实验操作与对应的实验目的或结论正确的是
选项
实验操作
实验目的或结论
A
往某溶液中加入BaCl2溶液产生白色沉淀
该溶液含有SO42-
B
将氯气分别通入KI溶液和NaBr溶液中
证明还原性的强弱:I-> Br-> Cl-
C
由Fe-Cu做电极,浓硝酸做电解质溶液组成的原电池
证明金属活泼性Fe>Cu
D
C2H5OH与浓硫酸170℃共热,制得的气体先通过足量的NaOH溶液,再通入酸性KMnO4溶液
使KMnO4溶液褪色的气体是乙烯
难度: 困难查看答案及解析
-
下列有关表述与图像对应关系不正确的是
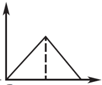
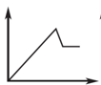
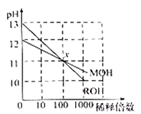
图1 图2 图3 图4
A.图1:往Na2CO3和NaOH混合液中逐滴加入盐酸,产生气体体积与盐酸的物质的量的关系
B.图2:往澄清石灰水中通入过量CO2气体,产生沉淀质量与CO2的物质的量的关系
C.图3:往AlCl3和MgCl2混合液中逐滴加入NaOH溶液,产生沉淀质量与NaOH溶液的物质的量的关系
D.图4:若MOH和ROH表示两种一元碱,则ROH的碱性强于MOH
难度: 困难查看答案及解析
-
莽草酸是合成达菲的主要原料,其结构简式如图所示,下列说法正确的是

A.分子式为C7H8O5
B.能使溴的四氯化碳溶液褪色
C.只能发生加成反应和取代反应
D.分子中含有2种官能团
难度: 中等查看答案及解析
-
在一定温度下,将气体X和Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
难度: 中等查看答案及解析