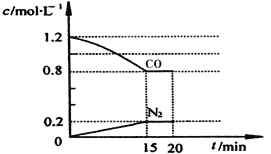
-
室温下,下列事实不能说明NH3•H2O为弱电解质的是
A. 0.1 mol•L﹣1 NH3•H2O溶液的pH小于13
B. 0.1 mol•L﹣1 NH3•H2O能使无色酚酞试液变红色
C. 相同条件下,浓度均为0.1 mol•L﹣1 NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol•L﹣1 NH4Cl溶液的pH小于7
难度: 困难查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是
A. 用10mL量筒量取7.13mL稀盐酸
B. 用托盘天平称量25.20g NaCl
C. 用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
D. 用广泛pH试纸测得某溶液的pH为2.3
难度: 简单查看答案及解析
-
下列说法正确的是
A. 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW
B. 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
C. 根据溶液的pH与酸碱性的关系,推出pH=6.8的溶液一定显酸性
D. 常温下,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为1:104
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A. 纯碱溶液中:Al3+、Ba2+、Cl-、NO3-
B. 室温下,c(H+)/c(OH-)=1×10-12的溶液中:K+、Na+、CO3-、NO3-
C. 无色溶液中:Na+、Al3+、Cl-、HCO3-
D. 室温下,pH=1的溶液中:K+、Fe2+、MnO4-、I-
难度: 中等查看答案及解析
-
下列有关说法正确的是 ( )
A. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B. 所有的化学反应都需要一定的活化能来推动
C. CH3COOH 溶液加水稀释后,溶液中
 的值增大
的值增大D. Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是
A. 向K2Cr2O4溶液中滴入浓的NaOH溶液后,溶液黄色加深
B. 高压比常压更有利于合成SO3
C. 反应2SO2+O2
2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
D. 合成氨反应:N2+3H2
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 一定条件下反应N2+3H2
2NH3,达到平衡时,3v正(H2)=2v正(NH3)
B. 25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸
C. 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3•H2O)变小
D. 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成
难度: 困难查看答案及解析
-
某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
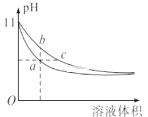
A. a点导电能力比b点强
B. a、c两点的c(H+)相等
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. b点的Kw值大于c点
难度: 困难查看答案及解析
-
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是
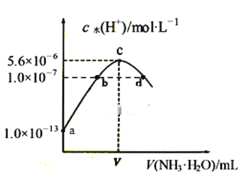
A. d点所示溶液中:c(NH4+)═2c(SO42−)
B. C点所示溶液中:c(H+)−c(OH−)═2c(NH3·H2O)
C. NH3·H2O的电离常数K=10−4
D. V=40
难度: 困难查看答案及解析
-
下列有关说法正确的是
A. 由MgCl2溶液制备无水MgCl2,将MgCl2溶液加热蒸干
B. 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
难度: 困难查看答案及解析
-
常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的量浓度均为0.1mol·L−1,下列说法错误的是
A. Na2CO3溶液加水稀释后,溶液中c(HCO3−)/c(CO32−)的值增大
B. 将③、④等体积混合所得溶液中:2c(OH−)−2c(H+)=3c(H2CO3)+2c(HCO3−)−c(CO32−)
C. 向溶液①、②中分别滴加25mL 0.1mol·L−1盐酸后,溶液中c(NH4+):①<②
D. 将溶液①、②等体积混合所得溶液呈碱性且:c(NH4+)>c(NH3·H2O)
难度: 困难查看答案及解析
-
准确取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·L−1NaOH溶液滴定,下列说法正确的是
A. 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
B. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D. 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
难度: 中等查看答案及解析
-
已知部分弱酸的电离平衡常数如表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25℃)
1.75×10−5
2.95×10−8
K1=4.3×10-7
K2=5.6×10-11
K1=1.54×10−2
K2=1.02×10−7
下列选项正确的是( )
A. 少量CO2通入NaClO溶液中:CO2+H2O+2ClO−═CO32−+2HClO
B. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO−═CaSO3↓+2HClO
C. 少量SO2通入Na2CO3溶液中:SO2+H2O+2CO32−═SO32−+2HCO3−
D. 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3−═CO2↑+H2O
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液
试管口出现红棕色气体
溶液中NO3-被Fe2+还原为NO2
B
测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH
前者pH比后者的大
非金属性:S>C
C
向NaHCO3溶液中滴加NaAlO2溶液
出现白色沉淀
酸性:HCO3−>Al(OH)3
D
向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液
先有白色沉淀生成后变为红褐色沉淀
相同温度下的Ksp:Mg(OH)2>Fe(OH)3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=−lgc(Ba2+),p(SO42−)=−lgc(SO42−)。下列说法正确的是

A. 该温度下,Ksp(BaSO4)=1.0×10−24
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
难度: 困难查看答案及解析