-
下列有关物质分类的说法正确的是
A. 胶体与溶液的本质区别是分散质粒子直径的大小
B. SiO2既能与NaOH 溶液反应,又能与氢氟酸反应,是一种两性氧化物
C. CO2 的水溶液可以导电,所以CO2 是电解质
D. H2SO4、NaOH、K2CO3 在水溶液中均能电离,它们均为离子化合物
难度: 中等查看答案及解析
-
下列说法正确的是
A. 容量瓶和分液漏斗使用前必须要检漏并干燥
B. 蒸馏操作时,温度计水银球应插入混合液
C. 焰色反应时,铂丝需用稀硫酸洗净,并在火焰上灼烧至无色
D. 配制溶液定容时,俯视容量瓶的刻度线,则所配制溶液的浓度偏高
难度: 中等查看答案及解析
-
化学点亮生活,下列对生活中的化学理解正确的是
A. 节日燃放的烟花,利用了金属元素焰色反应,燃放过程中对环境无污染
B. 古代合成颜料中国蓝的化学式为BaCuSi4O10,可改写成BaO·CuO·4SiO2
C. MnO2有较强的氧化性,可作H2O2分解的氧化剂
D. 赏心悦目的雕花玻璃是使用烧碱对玻璃刻蚀而成的
难度: 中等查看答案及解析
-
下列说法中正确的是
A. Al2O3、MgO可用作耐高温材料,二氧化硅是生产光纤制品的基本原料
B. 铝、铁、铜相比较,在自然界中铜元素的含量最低、铁元素含量最高
C. 工业上采用电解熔融态Al2O3、MgO的方法冶炼Al、Mg
D. 用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵的反应都会产生温室气体
难度: 中等查看答案及解析
-
有关漂白粉和漂白液的说法正确的是
A. 漂白粉是纯净物,漂白液是混合物 B. 漂白粉的有效成分是Ca(ClO)2
C. 工业上将氯气通入澄清石灰水制取漂白粉 D. 漂白液的有效成分是Na2O2
难度: 中等查看答案及解析
-
下列说法正确的是
A. 油脂和氨基酸在一定条件下均可以与氢氧化钠溶液反应
B. 棉、麻、丝、毛完全燃烧都只生成二氧化碳和水
C. 鸡蛋白水溶液中滴加硫酸铵溶液可使蛋白质发生变性
D. 煤的干馏是指高温下煤在空气中发生复杂的物理变化,得到苯、甲苯、二甲苯等
难度: 中等查看答案及解析
-
在标准状况下,下列说法正确的是
A. 等体积CH4和HF所含的电子数相同
B. pH=12的Na2CO3溶液中c(OH-)=1×10-2 mol/L
C. 2.4 g Mg与足量的盐酸反应,放出的气体体积为2.24 L
D. 由H2O2 制2.24 L O2转移的电子数目为0.4 NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 1 mol SO2与0.5 mol O2在一定条件下充分反应,转移电子数为2 NA
B. 含1 mol Cl-的NH4Cl溶液中NH4+数目小于NA
C. 10 g D216O和10 g H218O中含有的中子数均为5 NA
D. 向2 mL 0.5 mol/L硅酸钠溶液中滴入适量盐酸制硅酸胶体,所得胶粒数目小于0.001 NA
难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2===I2+2H2O
B. 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
D. 用铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O
H2↑+Cl2↑+2OH-
难度: 中等查看答案及解析
-
A、B、C、D、E、F为原子序数依次递增的六种短周期主族元素,A的单质是最理想的燃料,C原子次外层电子数是最外层的1/3,E与C同主族,下列说法不正确的是
A. 元素F最高价氧化物对应水化物一定是一种强酸
B. 元素D与A一定形成共价化合物
C. 元素B可能与元素A形成多种共价化合物
D. 若元素D是非金属元素,则D的单质可能是良好的半导体材料
难度: 中等查看答案及解析
-
汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是
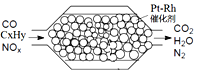
A. 尾气造成“雾霾”与汽油未充分燃烧有关
B. 尾气处理过程,氮氧化物(NOX)被还原
C. Pt-Rh催化剂可提高尾气净化反应的平衡转化率
D. 使用氢氧燃料电池作汽车动力能有效控制雾霾
难度: 中等查看答案及解析
-
下列有关实验操作或仪器的使用正确的是
A. 分液时取出下层液体
B. 存放浓硝酸

C. 收集NO气体
D. 吸收尾气中的SO2

难度: 中等查看答案及解析
-
秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是
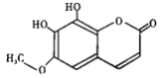
A. 1mol 该化合物最多能与3 mol NaOH 反应 B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成、氧化、取代等反应 D. 分子中有四种官能团
难度: 中等查看答案及解析
-
用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是
A. 标准状况下,11.2 L CO2中含碳氧双键的数目约为6.02×1023
B. 30 g HCHO被氧化时转移电子数目为4×6.02×1023
C. 反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O
D. 理论上,吸收的HCHO 与消耗Fe3+的物质的量之比为4∶1
难度: 中等查看答案及解析
-
将一定量的铜粉加入到0.5 L 0.3 mol•L﹣1 Fe2(SO4)3和0.1mol•L﹣1H2SO4的混合溶液中,铜粉完全溶解后,得到溶液X。下列说法正确的是
A. 溶液X中Cu2+与Fe2+的物质的量之比为2:1
B. 向溶液X中滴加KSCN溶液,未变红色,则加入铜粉质量为12.8 g
C. 向溶液X中加入足量铁粉,充分反应后,铁粉质量减少11.2 g
D. 向溶液X中加入0.18 L 5 mol•L﹣1NaOH溶液可使溶液中的金属离子完全沉淀
难度: 中等查看答案及解析
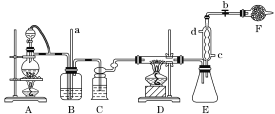



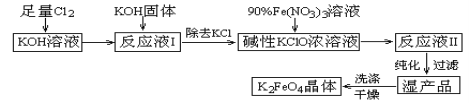

 ;
; 。
。