-
由下列实验及现象推出的相应结论正确的是
实验
现象
结论
A.某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有Fe2+,无Fe3+
B.向C6H5ONa溶液中通入CO2
溶液变浑浊
酸性:H2CO3>C6H5OH
C.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液
生成黑色沉淀
Ksp(CuS)<Ksp(ZnS)
D.①某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生产生活密切相关,下列说法错误的是
A. Na2O2可与CO2反应放出氧气,可用于制作呼吸面具
B. SiO2具有导电性,可用于制作光导纤维和光电池
C. 聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
D. 氯水具有较强的氧化性,可用于漂白纸张.织物等
难度: 中等查看答案及解析
-
下列分离方法正确的是
A. 回收水溶液中的I2:加入乙酸,分液,蒸发
B. 回收含有KCl的MnO2:加水溶解,过滤,干燥
C. 除去氨气中的水蒸气:通过盛有P2O5的干燥管
D. 除去乙醇中的水,加入无水氯化钙,蒸馏。
难度: 中等查看答案及解析
-
某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是
A. AgCl的溶解度、Ksp均减小 B. AgCl的溶解度、Ksp均不变
C. AgCl的溶解度减小、Ksp不变 D. AgCl的溶解度不变、Ksp减小
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小
B. 铁管镀锌层局部破损后,铁管仍不易生锈
C. 反应活化能越高,该反应越易进行
D. 不能用红外光谱区分C2H5OH和CH3OCH3
难度: 中等查看答案及解析
-
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
难度: 中等查看答案及解析
-
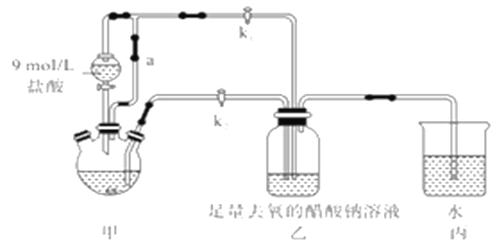
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeC13·6H2O)的工艺流程如下,下列说法错误的是

A. 将硫铁矿粉碎再焙烧的目的是加快反应速率
B. 酸溶时需保持盐酸过量的目的是提高铁元素的浸出率
C. 氧化剂Y可以是Cl2不能是H2O2
D. 上述流程中的FeS2可用FeS来代替
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 10 g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA
C. 将2 g H2分别与足量的Cl2和N2混合,充分反应后转移的电子数均为2NA
D. 1 mol Fe(OH)3与含3 mol HI的溶液完全反应后,溶液中所含I-的数目为3NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素,属于天然高分子化合物
B. 石油分馏、煤干馏均可得到烃及衍生物
C. 油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸(盐)
D. 乙酸乙酯和乙烯在一定条件下都能与水反应,二者属于同一反应类型
难度: 简单查看答案及解析
-
元素X、Y、Z、W、M、N的原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者的原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,Z2X4可以作火箭燃料,X2W2为18电子分子。均含X、W、M、N四种元素的两种常见化合物相互反应有带刺激性气味的气体放出。下列叙述错误的是
A. Y位于元素周期表的第2周期ⅣA族
B. X、Y、Z、W、M的原子半径由大到小的顺序为M>Y>Z>W>X
C. X、Z、W形成的盐中只含有离子键
D. 产生有刺激性气味气体的反应的离子方程式为H++HSO3- =H2O+SO2↑
难度: 中等查看答案及解析
-
有机物M、N、Q之间的转化关系为,下列说法正确的是( )

A. M的同分异构体有3种(不考虑立体异构)
B. N分子中所有原子共平面
C. Q的名称为异丙烷
D. M、N、Q均能与溴水反应
难度: 中等查看答案及解析
-
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2===H2O2+S,已知甲池中发生反应:
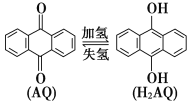 。下列说法正确的是
。下列说法正确的是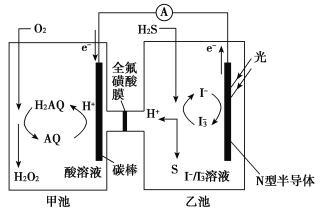
A. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-===H2AQ
B. 乙池溶液中发生的反应为H2S+I3-===3I-+S+2H+
C. 该装置中电能转化为光能
D. H+从甲池移向乙池
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4
CaCO3+SO42−
B. 酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+=I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO42−+3Cl−+4H++H2O
D. 电解饱和食盐水:2Cl−+2H+
Cl2↑+ H2↑
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)
Na2CO3(s)
NaOH(aq)
B. Al(s)
NaAlO2(aq)
Al(OH)3(s)
C. AgNO3(aq)
[Ag(NH3)2]+(aq)
Ag(s)
D. Fe2O3(s)
Fe(s)
FeCl3(aq)
难度: 中等查看答案及解析
-
根据下列图示所得出的结论不正确的是
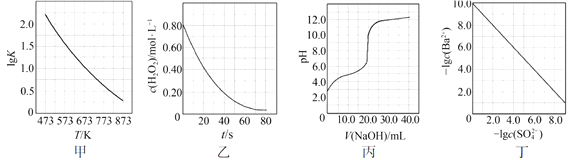
A. 图甲是CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
难度: 中等查看答案及解析
-
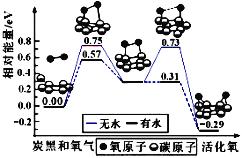
氢卤酸的能量关系如图所示下列说法正确的是
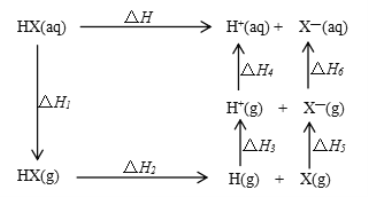
A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
难度: 中等查看答案及解析
-
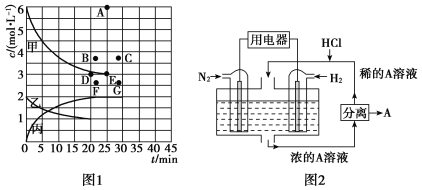
在常温下,向10mL浓度均为0.1mol·L-1的NaOH和Na2CO3混合溶液中滴0.1mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是
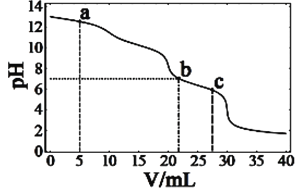
A. 在a点的溶液中,c(Na+)>c(CO32-)>c(Cl-)>c(OH-)>c(H+)
B. 在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001mol
C. 在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
D. 若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
难度: 困难查看答案及解析