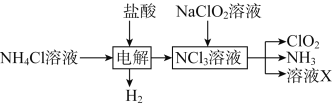
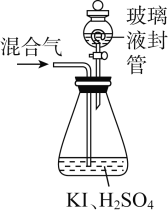
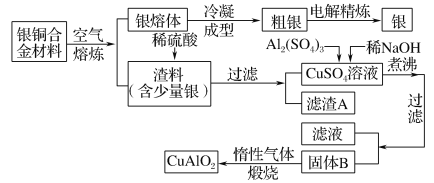
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B. 原子半径大小:X<Y,Z>W
C. 化合物Z2Y和ZWY3都只存在离子键
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
难度: 中等查看答案及解析
-
[2016全国Ⅲ]下列有关实验的操作正确的是
实验
操作
A.
配制稀硫酸
先将浓硫酸加入烧杯中,后倒入蒸馏水
B.
排水法收集KMnO4分解产生的O2
先熄灭酒精灯,后移出导管
C.
浓盐酸与MnO2反应制备纯净Cl2
气体产物先通过浓硫酸,后通过饱和食盐水
D.
CCl4萃取碘水中的I2
先从分液漏斗下口放出有机层,后从上口倒出水层
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列溶液一定是碱性的是 ( )
A. pH = 8的某电解质溶液 B. c(OH-)>1×10-7mol/L
C. 溶液中含有OH-. D. 溶液中c(OH-)>c(H+)
难度: 简单查看答案及解析
-
下列有关电解质溶液的说法不正确的是
A. 向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中
增大
B. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中
减小
C. 向盐酸中加入氨水至中性,溶液中
=1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
变小
难度: 中等查看答案及解析
-
一定能在下列溶液中大量共存的离子组是( )
A. 水电离产生的c(OH-)=1×10-12 mol·L-1液中:NH4+、Na+、Cl-、HCO3-
B. 能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C. 含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D. 澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42-
难度: 中等查看答案及解析
-
[2016天津]下列选用的仪器和药品能达到实验目的的是
A
B
C
D
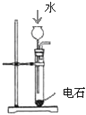
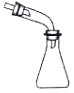
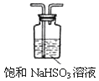

制乙炔的发生装置
蒸馏时的接收装置
除去SO2中的少量HCl
准确量取一定体积K2Cr2O7
标准溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
甲、乙、丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g)
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
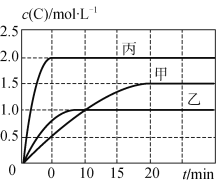
容器
甲
乙
丙
容积
0.5 L
0.5 L
1.0 L
温度/℃
T1
T2
T2
反应物
起始量
1.5 molA
0.5 molB
1.5 molA
0.5 molB
6.0 molA
2.0 molB
下列说法正确的是
A. 10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. 若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5 molA、1.5 molB,平衡时A的转化率为25%
难度: 中等查看答案及解析
-
利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是
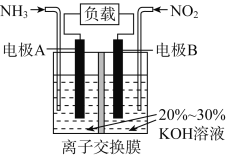
A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
难度: 困难查看答案及解析
-
某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图所示原电池,盐桥中装有饱和K2SO4溶液。下列说法正确的是
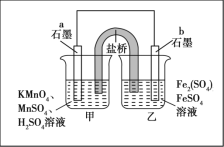
A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为MnO4-+8H++5e-=Mn2++4H2O
难度: 困难查看答案及解析
-
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积V L。则下列说法正确的是
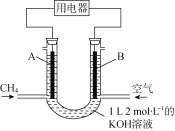
A. OH-由A端移向B端
B. 0<V≤22.4 L时,电池总反应的化学方程式为CH4 +2O2 +KOH===KHCO3 +2H2O
C. 22.4 L<V≤44.8 L时,负极电极反应为:CH4 +9CO32-+3H2O-8e-===10HCO3-
D. V=33.6 L时,溶液中阴离子浓度大小关系为c(CO32-)>c(HCO3-)>c(OH-)
难度: 困难查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
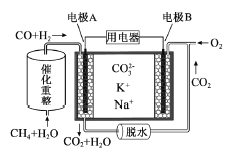
A. 反应CH4+H2O
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 中等查看答案及解析
-
用石墨作电极电解1 000 mL 0.1 mol·L-1 CuSO4溶液,通电一段时间后关闭电源,测得溶液的质量减少了9.8 g。下列有关叙述正确的是(NA代表阿伏加德罗常数)
A. 电解过程中流经外电路的电子个数为0.2NA B. 在标准状况下,两极共产生4.48 L气体
C. 电解后溶液的pH为1(溶液体积不变) D. 加入11.1 g Cu2(OH)2 CO3可将溶液彻底复原
难度: 中等查看答案及解析
-
向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2)
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C
0.015
c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D
0.03
c(Na+)> c(HCO3-)> c(OH-)>c(H+)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列描述中正确的是
A. 已知C(石墨,s)=C(金刚石,s) ∆H=+1.9kJ·mol-1,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
B. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的∆H=2×(+283.0) kJ·mol-1
C. 有些化学反应的发生不会伴随着能量的变化
D. 已知2H2(g)+O2(g)=2H2O(g) ∆H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ∙mol-1
难度: 中等查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是)
选项
已知
类推
A
将Fe加入CuSO4溶液中:Fe+Cu2+=== Cu+Fe2+
将Na加入到CuSO4溶液中:2Na+Cu2+=== Cu+2Na+
B
向Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-=== CaCO3↓+2HClO
向Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO
C
惰性电极电解氯化钠溶液:2Cl-+2H2O
2OH-+H2↑+Cl2↑
惰性电极电解MgBr2溶液:2Br-+2H2O
2OH-+H2↑+Br2
D
稀盐酸与NaOH溶液反应至中性:H++OH-===H2O
稀硝酸与Ba(OH)2溶液反应至中性:H++OH-===H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在密闭容器中充入一定量NO2,发生反应2NO2(g)
N2O4(g) ΔH=-57 kJ· mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
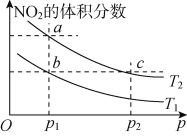
A. a、c两点的反应速率:a>c
B. a、b两点NO2的转化率:a<b
C. a、c两点气体的颜色:a深,c浅
D. 由a点到b点,可以用加热的方法
难度: 中等查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
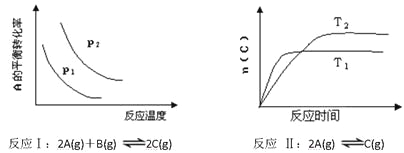
根据以上规律判断,下列结论正确的是
A. 反应Ⅰ:ΔH>0,P2>P1
B. 反应Ⅱ:ΔH>0,T1>T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T1>T2
D. 反应Ⅳ:ΔH<0,T2>T1
难度: 简单查看答案及解析
-
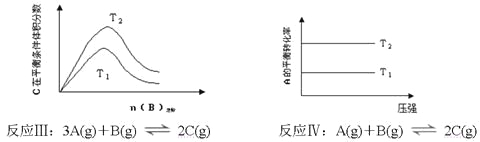
汽车尾气中NO产生的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是
A. 温度T下,该反应的平衡常数
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
难度: 中等查看答案及解析
-
298 K时,在20.0 mL 0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1 氨水的电离度为1.32%,下列有关叙述正确的是
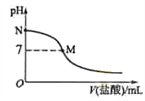
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
难度: 中等查看答案及解析
-
室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述不正确的是
①溶液的体积:10V甲≤V乙
②水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
③若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
④若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析