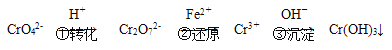-
在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液中:K+、Al3+、Cl-、SO42-
B. 室温下,pH=1的盐酸中:Na+、Fe2+、NO3-、SO42-
C. 含有Ca2+的溶液中:Na+、K+、CO32-、Cl-
D. 水电离产生的c(H+)=1×10-13 mol/L的溶液中:Na+、K+、Cl-、SO42-
难度: 中等查看答案及解析
-
物质的量浓度相同的以下溶液:①NH4HSO4 ②(NH4)2CO3 ③NH4Fe(SO4)2 ④NH4NO3 ⑤NH4HCO3,C(NH4+)由大到小的顺序为
A. ②①③④⑤ B. ③①④②⑤ C. ①③④⑤② D. ①④②⑤③
难度: 中等查看答案及解析
-
某学生的实验报告中,描述合理的是( )
A. 用10mL量筒量取7.13mL稀盐酸
B. 用托盘天平称量25.20g NaCl
C. 用25mL碱式滴定管量取出15.00mLKMnO4溶液
D. 用25mL碱式滴定管做酸碱中和滴定实验时,共用去某浓度的碱溶液21.70mL
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
B. 25 ℃时,1L 0.1mol/L Na2S溶液中阴离子总数小于0.1NA
C. 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA
D. 钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为NA
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是
①有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子数目,从而使反应速率增大。
②其他条件不变,温度越高,化学反应速率越快。
③6mol·L﹣1·s﹣1的反应速率一定比3.5mol·L﹣1·s﹣1的反应速率大。
④升高温度能增大反应物分子中活化分子的百分数。
⑤恒温时,增大压强,化学反应速率一定加快。
⑥增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多。
A. ①②⑤ B. ②④ C. ②⑤ D. ③ ⑥
难度: 中等查看答案及解析
-
化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( )
选项
现象或事实
解释或对应的离子方程式
A
用热的纯碱溶液洗去油污
CO32-+H2O
HCO3-+OH-
溶液呈碱性,温度升高碱性增强
B
酸雨样品在空气中放置pH减小
SO2+H2O=H2SO3
C
用泡沫灭火器灭火
Al3+ + 3HCO3-= Al(OH)3↓+3CO2↑
D
用加热法除去NaCl固体中混有的NH4Cl固体
NH4Cl固体可以完全分解成为气体而除去
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某反应由两步反应A
B
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
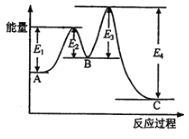
A. A→C的反应为放热反应 B. 稳定性C>A>B.
C. A→C的反应中,△H=(E2+E4)-(E1+E3) D. 加入催化剂不会改变反应的焓变
难度: 中等查看答案及解析
-
如图所示,ΔH1=−393.5 kJ·mol−1,ΔH2=−395.4 kJ·mol−1,下列有关说法或表示式正确的是( )

A. C(s,石墨) = C(s,金刚石) ΔH=−1.9 kJ·mol−1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性比石墨的弱
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 中等查看答案及解析
-
已知2SO2(g)+O2(g)
2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
A. 2a2=a1=197 kJ B. 2a2<a1<197 kJ
C. a2>a1>197 kJ D. 197 kJ>a1=2a2
难度: 困难查看答案及解析
-
用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
CuSO4
CuO
C
C
C
H2SO4
H2SO4
D
Ag
Fe
AgNO3
AgNO3晶体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
合成氨反应为:3H2+N2
2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是( )
A. 3v(H2)正 = v(N2)逆 B. v(H2)生成= v(NH3)生成
C. v(N2)消耗 = 2v(NH3)消耗 D. 2v(H2)逆 = 3v(NH3)正
难度: 中等查看答案及解析
-
室温下,有2种溶液0.01 mol·L-1 NH3·H2O和0.01 mol·L-1 NH4Cl,下列操作可以使2种溶液中c(NH4+)都增大的是( )
A. 通入少量HCl气体 B. 加入少量H2O
C. 加入少量NaOH固体 D. 升高温度
难度: 中等查看答案及解析
-
质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2+4H++4e-2H2O
②负极反应为:2H2-4e-4H+
③总的化学反应为:2H2+O2
2H2O
④氢离子通过电解质向负极移动
A. ①② B. ②③④ C. ①② ③ D. ①②③④
难度: 中等查看答案及解析
-
某同学设计如图所示装置,探究氯碱工业原理,下列说法正确的是
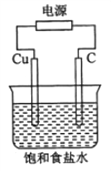
A. 石墨电极与直流电源负极相连
B. 铜电极的反应式为:2H2O+2e-
2OH-+H2↑
C. 氢氧化钠在石墨电极附近产生, Na+ 向石墨电极迁移
D. 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
难度: 中等查看答案及解析
-
可逆反应:A+B
C,在低温下能自发进行,在高温下不能自发进行,对该反应过程ΔH、ΔS的判断正确的是
A.ΔH>0、ΔS>0 B.ΔH<0、ΔS<0
C.ΔH<0、ΔS>0 D.ΔH>0、ΔS<0
难度: 中等查看答案及解析
-
为了除去
,酸性溶液中的
,可在加热搅拌的条件下加人一种试剂,过滤后,再向滤液中加入适量盐酸。这种试剂是 ( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
已知25℃时一些难溶物质的溶度积常数如下:
化学式
Zn(OH)2
ZnS
AgCl
Ag2S
MgCO3
Mg(OH)2
溶度积
5×10-17
2.5×10-22
1.8×10-10
6.3×10-50
6.8×10-6
1.8×10-11
根据上表数据,判断下列化学过程不能实现的是( )
A. 2AgCl+Na2S = 2NaCl+Ag2S
B. MgCO3+H2O = Mg(OH)2+CO2↑
C. ZnS+2H2O = Zn(OH)2+H2S↑
D. Mg(HCO3)2+2Ca(OH)2 = Mg(OH)2↓+2CaCO3↓+2H2O
难度: 中等查看答案及解析
-
对于0.1mol•L-1 Na2CO3溶液,下列说法正确的是( )
A.升高温度,溶液的pH降低
B.c(Na+)=2c(CO32―)+ c(HCO3―)+ c(H2CO3)
C.c(Na+)+c(H+)=2 c(CO32―)+ 2c(HCO3―)+ c(OH―)
D.加入少量NaOH固体,c(CO32―)与c(Na+)均增大
难度: 中等查看答案及解析
-
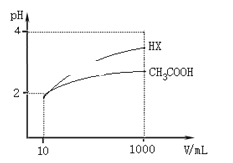
常温下,在20.0mL0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述不正确的是( )
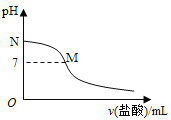
A. 该滴定过程应该选择甲基橙作为指示剂
B. M点对应的盐酸体积大于20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D. N点处的溶液中pH小于12
难度: 困难查看答案及解析
-
下列溶液或浊液中,关于离子浓度的说法正确的是
A. 一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小
B. 浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)]
C. 0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+)
D. 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
难度: 困难查看答案及解析