-
(NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__________、__________。
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。
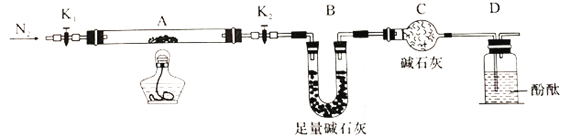
①仪器B的名称是__________。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式____________________。
③C的作用是__________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”);滴定时边滴边摇动锥形瓶,眼睛应观察__________。
②滴定结果如下表所示
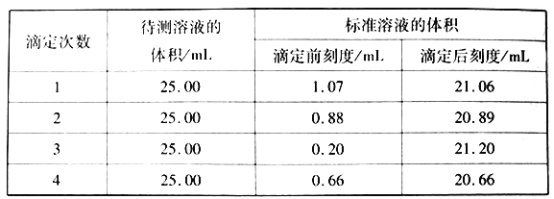
该样品中氮的质量分数为__________。
-
利用银镜反应给玻璃镀上一层银是化学镀的一种,某化学兴趣小组设计的给ABS工程塑料零件先化学镀,后电镀的工艺流程如下,回答下列问题:
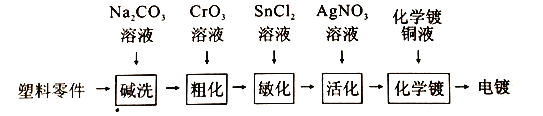
(1)塑料零件不能直接进行电镀的原因是____________________,Na2CO3溶液可用于除去塑料零件表面的油污,理由是____________________(用离子方程式表示)。
(2)粗化是利用粗化液与塑料表面的高分子化合物反应,使塑料表面粗糙不平;粗化液的主要成分CrO3(铬酐),由重铬酸钠与浓硫酸加热熔融反应、再分离除去硫酸氢钠制得,写出该反应的化学方程式____________________。
(3)经粗化的塑料表面浸渍过敏化剂氯化亚锡溶液,表面吸附一层易于氧化的Sn2+离子。用氯化亚锡晶体(SnCl2·2H2O)配制氯化亚锡溶液时,还需要的试剂有____________________。
(4)活化是将经过敏化处理的塑料与硝酸银溶液反应,在塑料表面吸附一层具有催化活性的金属微粒,写出生成有催化活性的金属微粒的离子方程式____________________。
(5)将经活化处理的塑料置于含有Cu(OH)2、HCHO、NaOH的化学镀铜液中一段时间,可以在塑料表面镀上一层厚度为0.05-0.2μm的金属导电薄层,同时生成HCOONa和H2,若两种还原产物的物质的量相等,写出该反应的化学方程式____________________。
(6)塑料经化学镀的镀层厚度不能满足产品的防腐、耐磨等方面的要求,必须采用电镀镀到所需的厚度,电镀时,有金属导电薄层的塑料作电镀池的_____极,维持电流强度为1.5A,电镀5分钟,理论上塑料表面析出铜__________g。(已知F=96500C·mol-1)
-
汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)汽车燃料中不含氮元素,尾气中所含NO产生的原因是____________________。
(2)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为____________________。
②部分化学键键能数据如下:
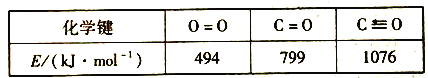
△H2=__________kJ·mol-1
(3)1573K时,N2+O2 2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(4)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1.68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是____________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要____________________。
(5)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A.反应速率与NO浓度有关 B.反应速率与NO2浓度有关
C.反应的中间产物只有NO3 D.第二步反应活化能较高
-
钙及其化合物在工业上、建筑工程上和医药上用途很大。回答下列问题
(1)基态Ca原子M能层有_____个运动状态不同的电子,Ca的第一电离能__________(填“大于”或“小于”)Ga。
(2)Mn和Ca属于同一周期,且核外最外层电子构型相同,但金属Mn的熔点沸点等都比金属Ca高,原因是____________________。
(3)氯气与熟石灰反应制漂白粉时会生成副产物Ca(ClO3)2,Ca(ClO3)2中的阴离子空间构型是__________、中心原子的杂化形式为___________。
(4)碳酸盐的热分解示意图如图所示
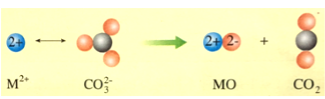
热分解温度:CaCO3_______ (填“高于”或“低于”)SrCO3,原因是_____________________________。从价键轨道看,CO2分子内的化学键类型有__________。
(5)萤石是唯一一种可以提炼大量氟元素的矿物,晶胞如图所示。Ca2+的配位数为__________,萤石的一个晶胞的离子数为__________,已知晶胞参数为0.545nm,阿伏加德罗常数的值为NA,则萤石的密度为__________g·cm-3(列出计算式)。

-
芳纶可以制成防弹衣、防弹头盔、防弹装甲等,对位芳纶纤维J(聚对苯二甲酰对苯二胺)是重要的国防军工材料。化合物A、乙烯、苯制备J的一种合成路线如下:
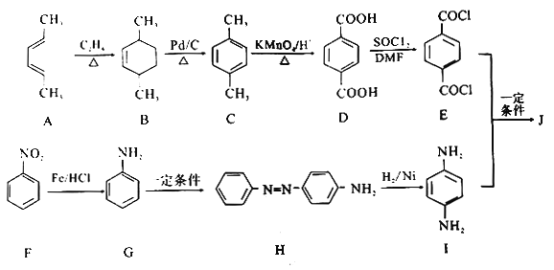
回答下列问题:
(1)A的化学名称为____________________。
(2)A→B的反应类型是____________________。
(3)实验室由苯制备F所需试剂、条件分别为____________________。
(4)G中官能团的名称是____________________。
(5)E与I反应生成J的化学方程式为____________________。
(6)写出与D互为同分异构体的只含酯基的结构简式(核磁共振氢谱为四组峰,峰面积比为2:2:1:1____________________。
(7)参照上述合成路线,以1,3-戊二烯和丙烯为原料(无机试剂任选),设计制备邻苯二甲酸的合成路线____________________。

 B.
B.  C.
C. 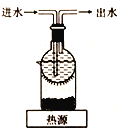 D.
D.