-
以下有关元素性质的说法不正确的是( )
A. ①Na,K,Rb ②N,P,As ③O,S,Se ④Na,P,Cl元素的电负性随原子序数增大而递增的是④
B. 下列原子中,①1s22s22p63s23p1②1s22s22p63s23p2③1s22s22p63s23p3④1s22s22p63s23p4对应的第一电离能最大的是④
C. 某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,该元素可能在第三周期第ⅡA族
D. 以下原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4半径最大的是①
难度: 困难查看答案及解析
-
下列叙述中,正确的是:
A. 在基态多电子的原子中,可以有两个运动状态完全相同的电子
B. 在基态多电子的原子中,不可能有两个能量完全相同的电子
C. 在基态多电子的原子中,M层的电子能量肯定比L层上的电子能量高
D. 如果某一基态原子3p能级上仅有2个电子,它们自旋方向必然相反
难度: 中等查看答案及解析
-
下列各组表述中,两个微粒一定不属于同种元素原子的是
A. 3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B. M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C. 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D. 2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
难度: 中等查看答案及解析
-
2016年IUPAC命名117号元素为Ts (中文名“
”,tián),下列有关Ts的说法不正确的是( )
A. Ts的电子所在最高能层符号是Q B. Ts的原子有一个未配对电子
C. Ts的电负性在同周期主族元素中最大 D. Ts 原子有7种能量相同的电子
难度: 中等查看答案及解析
-
导电仪测得液态BrF3具有微弱的导电性,表示BrF3(液)中有阴、阳离子X和Y。X和Y也存在于BrF2SbF6、KBrF4、(BrF2)2SnF6等化合物中,则X、Y的化学式分别为( )
A. X=F-;Y=Br3+ B. X=F-;Y=BrF2+ C. X=BrF4-;Y=BrF2+ D. X=BrF4-;Y=Br3+
难度: 困难查看答案及解析
-
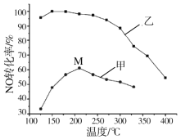
在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )

A. 0~t2内用M表示的平均反应速率是2/t2(mol·L-1·min-1)
B. t1~t2内容器内的压强逐渐减小
C. 该反应的方程式为N
2M
D. t2与t3时刻的混合气体的平均相对分子质量相等
难度: 简单查看答案及解析
-
下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )
A. Al、Mg、Na B. N、O、C C. K、Na、Li D. Cl、S、P
难度: 中等查看答案及解析
-
常温下,将下列物质的稀溶液(浓度均为0.1mol·L-1)加热使溶液温度升高到45℃(忽略溶液体积变化),溶液的pH不变的是
A. H2SO4溶液 B. KCl溶液 C. NH4Cl溶液 D. NaOH溶液
难度: 中等查看答案及解析
-
具有以下结构的原子一定属于p区元素的是( )
①最外层有3个电子的原子 ②价电子有3个电子的原子 ③最外层有3个未成对电子的原子 ④价电子有3个未成对电子的原子
A. ②③ B. ①④ C. ②④ D. ①③
难度: 中等查看答案及解析
-
下列实验现象及结论正确的是
A. 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP (AgCl)> KSP (AgI)
B. 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者
C. Na2CO3溶液滴入足量硼酸溶液中,无气泡生成,说明Ka: H2CO3>H3BO3
D. 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者等于后者
难度: 中等查看答案及解析
-
Co(H2PO2)2广泛用于化学镀钴,以金属Co和NaH2PO2为原料,采用四室电渗析槽电解法制备,原理如图。下列叙述正确的是

A. b为阳离子交换膜
B. 通电后原料室的H2PO2−向产品室迁移,阴极区溶液pH增大
C. 石墨电极反应为4OH−−4e−
O2↑+2H2O
D. 当产生1 mol Co(H2PO2)2时,产生标准状况下气体11.2 L
难度: 困难查看答案及解析
-
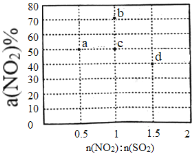
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如右图所示。下列说法错误的是

A. Z与M的最高价氧化物对应水化物均为强酸
B. X、Y、Z三种元素组成的化合物可能是酸、碱或盐
C. 简单离子半径:M > Y > Q
D. 电解RM2水溶液可得到R单质
难度: 中等查看答案及解析
-
在一密闭容器中充入3 mol A和2 mol B发生如下反应:3A(g)+B(g)
xC(g)。该反应达到平衡后,C的体积分数为W%。若维持容器的容积和温度不变,按起始物质的量A 0.6 mol、B 1.2 mol、C 1.6 mol充入容器达到平衡后,C的体积分数还为W%。则x的值( )
A. 只能为2 B. 只能为4 C. 可能为2,可能为4 D. 无法确定
难度: 困难查看答案及解析
-
甲醇脱氢可制取甲醛CH3OH(g)
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )

A. 脱氢反应的△H<0
B. 在t1K时,该反应的平衡常数为8.1
C. 600K时,Y点甲醇的υ(正) <υ(逆)
D. 若增大体系压强,曲线将向上平移
难度: 困难查看答案及解析
-
甲胺(CH3NH2)的性质与氨相似。25℃时,实验室里用0.1mol/L的盐酸溶液滴定20mL0.1mol/L甲胺溶液,滴定曲线如图所示。(已知:AG=lg[c(H+)/c(OH-)])下列说法正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. 水的电离程度:d>c>b>a
C. Kb(CH3NH2·H2O)=1×10-5
D. b点溶液中存在:c(H+)-c(OH-)=c(CH3NH2·H2O)-c(CH3NH3+)
难度: 困难查看答案及解析
-
工业上常采用吸收-电解联合法除去天然气中的H2S气体,并转化为可回收利用的单质硫,其装置如下图所示。通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率即可保证装置中反应的连续性。下列说法正确的是

A. 与电源a端相连的碳棒为阳极,气体A为O2
B. 与电源b端相连的碳棒上电极反应为:2H2O+2e-=2OH-+H2↑
C. 通电过程中,右池溶液中的OH-通过阴离子膜进入左池
D. 在通电前后,右池中的c(NaOH)与c(Na2S)之比基本不变
难度: 中等查看答案及解析
-
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知转化过程中的反应为2CrO42-(aq)+2H+(aq)
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
难度: 简单查看答案及解析
-
25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是
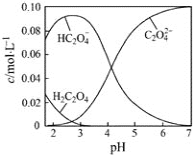
A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
难度: 困难查看答案及解析
-
下表列出了前20号元素中的某些元素性质的有关数据
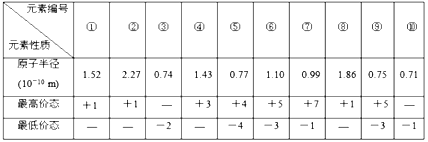
元素R的原子半径为1.02×10-10 m,下列有关叙述正确的是
A. 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧
B. 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4
C. 元素R在周期表中位于第三周期第ⅤI族
D. 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式
难度: 困难查看答案及解析
-
用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
难度: 困难查看答案及解析