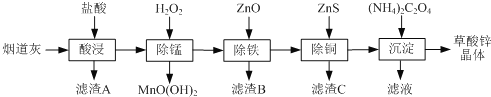
-
已知常温下Ksp(AgCl)=1.6×10-10、Ksp(AgI)=2.0×10-16,下列说法中正确的是
A.含有大量Cl-的溶液中肯定不存在Ag+
B.AgI悬浊液中加入少量KI粉末,平衡AgI(s) Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小
Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中逐渐加入KI固体至c(I-)=Ksp(AgI)/Ksp(AgCl)mol·L-1时,AgCl开始向AgI沉淀转化
D.向浓度均为0.01 mol·L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中I-的浓度为1.25×10-8 mol·L-1
-
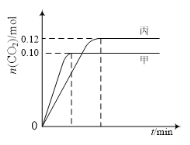
一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
| 容器 | 温度/℃ | 起始物质的量/mol |
| NO (g) | CO (g) |
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
-
下列有关说法正确的是
A. 铅蓄电池放电过程中,正极质量增加,负极质量减小
B. 若电工操作中将铝线与铜线直接相连,会导致铝线更快被氧化
C. 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D. 0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中c(OH-)、CH3COOH浓度均减少
-
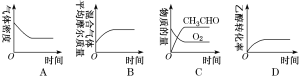
下列图示与对应的叙述相符的是

A. 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
-
下列指定反应的离子方程式正确的是
A. Na2CO3水【解析】
CO32-+H2O == H2CO3+2OH-
B. NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C. Cu与稀HNO3反应:Cu+4H++2NO3-=Cu2++2NO↑+2H2O
D. 醋酸除水垢:CO32-+2CH3COOH===2CH3COO-+CO2↑+H2O
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使酚酞变红的溶液中:Mg2+、Al3+、NO3-、ClO-
B. 与Al反应能放出H2的溶液中:Na+、Cu2+、NO3-、I-
C. 0.1 mol·L-1 Na2CO3溶液中:NH4+、K+、SO42-、Cl-
D. c(H+)/c(OH-)=1×1012的溶液中:Ca2+、Na+、SiO32-、HCO3-
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH﹣4e-+H2O═CH3COOH+4H+.下列有关说法正确的是
A. 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O
B. 若有0.4mol电子转移,则在标准状况下消耗4.48 L氧气
C. 检测时,电解质溶液中的H+向负极移动
D. 正极上发生的反应为:O2+4e-+2H2O═4OH-
-
NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法正确的是

A. 放电时,NO3-向石墨Ⅱ电极迁移
B. 石墨Ⅱ附近发生的反应为NO+O2+e-===NO3-
C. 该电池总反应式为4NO2+O2===2N2O5
D. 当外电路通过4 mol e-时,负极上共产生2mol N2O5
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
-
在密闭容器中,m A(g)+n B(g)  p C(g)反应达平衡时,测得 c(A)为 0.5mol•L‾1,温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3mol•L‾1,则下列判断中正确的是
p C(g)反应达平衡时,测得 c(A)为 0.5mol•L‾1,温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3mol•L‾1,则下列判断中正确的是
A. 平衡向正反应方向移动 B. 物质B的转化率减小
C. m + n <p D. 物质C的体积分数增加
-
25 ℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是
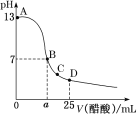
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 用含a的代数式表示CH3COOH的电离常数K=2.5×10—7/(0.2a-2.5)
C. C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
-
一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 2 | 4 | 6 | 8 |
| n(SO3) / mol | 0 | 0. 8 | 1. 4 | 1.8 | 1.8 |
下列说法正确的是
A. 反应在前2 s 的平均速率v(O2) = 0. 4 mol·L-1·s-1
B. 保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C. 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D. 保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大