-
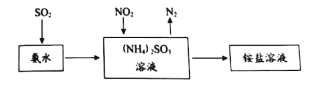
黑火药是硫磺粉、硝石、木炭粉按一定比例混合而成。古文献《本草经集注》记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”。下列推断不正确的是
A. “紫青烟”主要是指钾元素的焰色反应
B. “朴消”在灼烧时火焰没有颜色
C. “硝石”在黑火药中起氧化剂的作用
D. “朴消”不能替代“硝石”制黑火药
难度: 简单查看答案及解析
-
下列实验操作、实验现象、解释或结论不对应的是
选项
实验操作
实验现象
解释或结论
A
将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近
产生大量白烟
氨气与氯化氢反应生成固体物质
B
常温下,将洁净的铁片放入浓硫酸或浓硝酸中
无明显变化
常温下,浓硫酸、浓硝酸使铁片钝化
C
在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中
产生苍白色火焰
物质燃烧不一定需要氧气
D
向某无色溶液中滴加盐酸
产生能使澄清石灰水变浑浊气体
说明溶液中一定含有CO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验现象和结论或原因相符的是
操作及现象
原因或结论
A
一块表面打磨过的铝箔在酒精灯上加热至熔化,液态铝不会滴落
铝的熔点高于三氧化二铝
B
某溶液中加入硝酸银,产生白色沉淀
溶液中一定含有Cl-
C
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色
溶液中有Na+,无K+
D
向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红
溶液中一定含有Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知有如下反应:① 2BrO3-+Cl2=Br2+2ClO3-
② ClO3-+5Cl-+6H+=3Cl2+3H2O
③ 2FeCl2+Cl2=2FeCl3。根据上述反应,判断下列结论中错误的是
A. Cl2在反应②中既是氧化产物又是还原产物
B. Cl2在①、③反应中均作氧化剂
C. 氧化性强弱的顺序为:BrO3->ClO3-> Cl2 >Fe3+
D. 溶液中可发生:ClO3-+6Fe2++ 6H+ = Cl-+6Fe3+ + 3H2O
难度: 简单查看答案及解析
-
环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A. 温室效应——CO2 B. 白色污染——建筑垃圾
C. 酸雨——SO2 D. 雾霾——化石燃料
难度: 简单查看答案及解析
-
下列各组物质,按酸、碱、盐、非电解质的顺序排列的是
A. 硫酸、纯碱、氯化镁、二氧化碳 B. 硝酸、烧碱、干冰、苏打水
C. 醋酸、消石灰、明矾、铜 D. 氯化氢、苛性钠、小苏打、氨气
难度: 简单查看答案及解析
-
下列关于胶体的叙述中不正确的是
A. 丁达尔现象可用来区别胶体与溶液
B. 溶液、胶体、浊液的根本区别是分散质粒子直径的大小
C. 胶体在一定条件下会发生聚沉
D. 胶体粒子能通过半透膜,不能通过滤纸
难度: 简单查看答案及解析
-
下列应用不涉及氧化还原反应的是
A. 工业上制粗硅并提纯
B. 用FeCl3溶液作为“腐蚀液”刻蚀电路铜板
C. 实验室制CO2
D. 用Na2O2作潜水艇的供氧剂
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
难度: 简单查看答案及解析
-
下列溶液中的离子—定能大量共存的是
A. 含大量MnO4-的溶液中:Na+、K+、Cu2+、Fe3+
B. 在加入铝粉能产生氢气的溶液中:NH4+、Na+、SO42-、CO32-
C. 酸性溶液中:Ba2+、NO3-、K+、AlO2-
D. 含大量Fe3+的溶液中:NH4+、Na+、I-、SCN-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
B. 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O
C. 铝片与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
D. 金属铝溶于盐酸中:Al+2H+=Al3++H2↑
难度: 中等查看答案及解析
-
某试剂瓶上贴有如下标签,对该试剂理解正确的是

A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0 mol/L Na2SO4溶液的c(Na+)相等
难度: 简单查看答案及解析
-
两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同的
A. 电子总数 B. 质子总数 C. 原子总数 D. 质量
难度: 简单查看答案及解析
-
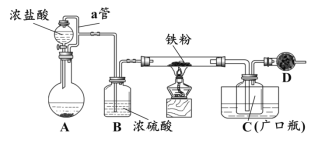
实验室制取少量干燥的氨气涉及下列装置中,其中正确的是

A. ①是氨气发生装置 B. ③是氨气发生装置
C. ②是氨气吸收装置 D. ④是氨气收集、检验装置
难度: 中等查看答案及解析
-
有关过氧化钠与水反应,下列说法错误的是
A. 产生的气体可以使带火星的木条复燃
B. 1mol过氧化钠完全参加反应,将转移电子2mol
C. 反应后的溶液中滴加酚酞后溶液将变红,震荡后红色消失
D. 该反应是放热反应
难度: 简单查看答案及解析
-
实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是
A. 配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B. 可在FeCl2溶液的上面加一层苯,以隔绝空气
C. 向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D. 产生Fe(OH)2沉淀后,不能震荡试管
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. 硫粉在过量的纯氧中燃烧可以生成SO3
B. 可以用澄清石灰水鉴别SO2和CO2
C. SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性
D. SO2通入到紫色石蕊试液中,溶液只变红不褪色
难度: 中等查看答案及解析
-
下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
难度: 简单查看答案及解析
-
在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法
现象
结论
A
观察氯水颜色
氯水呈黄绿色
氯水中含Cl2
B
向饱和NaHCO3溶液中加入足量氯水
有无色气体产生
氯水中含HClO
C
向红色纸条上滴加氯水
红色纸条褪色
氯水具有漂白性
D
向FeCl2溶液中滴加氯水
溶液变成棕黄色
氯水具有氧化性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
碘在自然界中有很多存在形式,在地壳中主要以NaIO3 形式存在,在海水中主要以I-形式存在,几种粒子与Cl2之间有以下转化关系:
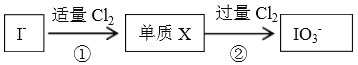
以下说法不正确的是
A. ①中发生的反应是:2I-+Cl2=I2+2Cl-
B. I-与过量Cl2发生的反应是:I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. 以上反应中,氯气都体现氧化性,具体表现为:氯元素由0价降低为-1价
D. 通过以上信息,可预测:若在加入淀粉的KI溶液中逐滴滴加氯水,不能观察到溶液变蓝的现象
难度: 中等查看答案及解析
-
取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
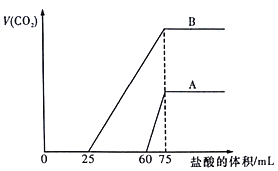
A. B 曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
难度: 困难查看答案及解析