-
在常温下,pH=2的氯化铁溶液,pH=2的硫酸溶液,pH=12的氨水溶液,pH=12的碳酸钠溶液,水的电离程度分别为a、b、c、d,则这四种溶液中,水的电离程度大小比较正确的是( )
A. a=d>b=c B. a=d>c>b C. b=c>a=d D. b=c>a>d
难度: 中等查看答案及解析
-
下列表示物质结构的化学用语正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 异丙基的结构简式:-CH(CH3)2
C. 羟基的电子式:
D. 新戊烷的结构简式:

难度: 简单查看答案及解析
-
如图是常见四种有机物的比例模型示意图。下列说法不正确的是( )
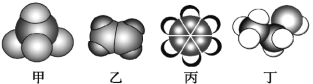
A. 甲不能使酸性高锰酸钾溶液和溴水均褪色
B. 乙可使酸性高锰酸钾溶液和溴水均褪色,且反应类型也相同.
C. 丙不能使酸性高锰酸钾溶液和溴水反应而褪色
D. 丁能使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2Cl2、丙烷、戊醇、苯,下列说法不正确的是( )
A. CH2Cl2有两种同分异构体
B. 丙烯能使溴水褪色
C. 戊醇与乙醇都含有羟基
D. 苯与足量氢气在镍催化作用下会发生加成反应生成环己烷
难度: 简单查看答案及解析
-
下列关于同系物和同分异构体的判断正确的是( )
A. C5H12有4种同分异构体
B.
还有4种含有苯环的同分异构体
C. C9H20与C2H6一定互为同系物关系
D. C4H8与C2H4一定互为同系物关系
难度: 简单查看答案及解析
-
有机物
的一氯代物共有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.7种
难度: 困难查看答案及解析
-
不能说明苯分子中的碳碳键不是单、双键交替的事实是( )
A. 苯不能使酸性高锰酸钾溶液褪色 B. 苯环中的碳碳键的键长均相等
C. 苯的邻位二元取代物没有同分异构体 D. 苯的一元取代物没有同分异构体
难度: 中等查看答案及解析
-
丙烯醇(CH2=CH-CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A. 只有①②③ B. 只有①②③④ C. ①②③④⑤ D. 只有①③④
难度: 中等查看答案及解析
-
1mol丙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气为
A.5mol B.6mol C.7mol D.8mol
难度: 中等查看答案及解析
-
下列实验事实不能证明醋酸是弱电解质的是( )
A. 相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B. 常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C. 常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D. 在相同条件下,醋酸溶液的导电性比盐酸的弱
难度: 中等查看答案及解析
-
下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O
S2-+H3O+
难度: 中等查看答案及解析
-
下列各溶液中能大量共存的离子组是( )
A. 使酚酞溶液呈红色的溶液中:Mg2+、Cu2+、SO42-、K+
B. 使pH试纸呈红色的溶液中;Fe2+、I-、NO3-、Cl-
C. 常温下c(H+)=10-14 mol·L-1溶液中:Na+、AlO2-、S2-、SO32-
D. 常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO3-、Ca2+
难度: 中等查看答案及解析
-
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有
c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka,醋酸根水解平衡常数为Kh,水的离子积为Kw,则有:
Ka ∶Kh=Kw
A.①④ B.①②④ C.②③ D.③④
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 洗涤油污常用热的碳酸钠溶液
B. 用加热的方法可以除去KCl溶液中的Fe3+
C. 配制FeSO4 溶液时,将FeSO4 固体溶于稀盐酸中,然后稀释至所需浓度
D. 将AlCl3溶液和Na2SO3溶液分别加热蒸干、灼烧后,所得固体为Al2O3和Na2SO3
难度: 困难查看答案及解析
-
在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度
增大
D. 加入MgCl2固体,HS-浓度减小
难度: 简单查看答案及解析
-
已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. a点无ZnS沉淀生成
B. 可用MnS除去MnCl2溶液中混有的少量ZnCl2
C. 向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
D. CuS和MnS共存的悬浊液中,
难度: 困难查看答案及解析