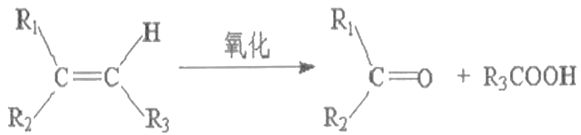
-
下列有关滴定操作的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低
C. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高
D. 用未知浓度的盐酸滴定标准的KOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
难度: 简单查看答案及解析
-
已知反应BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能进行完全。以下推断中正确的是
A. BeCl2溶液pH<7,将其蒸干、灼烧后可得残留物BeCl2
B. Na2BeO2溶液pH>7,将其蒸干、灼烧后可得残留物Na2BeO2
C. Be(OH)2能溶于盐酸,不能溶于NaOH溶液
D. BeCl2水溶液的导电性强,BeCl2一定是离子晶体
难度: 中等查看答案及解析
-
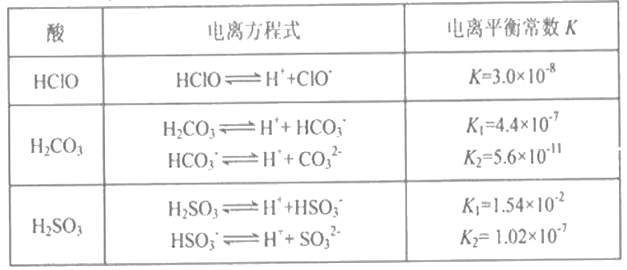
以下是常温下几种弱酸的电离平衡常数:
CH3COOH
H2S
HClO
K=1.8×10-5
K1=1.3×10-7
K2=7.1×10-15
K=4.69×10-11
下列说法正确的是
A. 可发生反应:H2S+ 2ClO-=S2-+ 2HClO
B. CH3COOH溶液与Na2S溶液不能反应生成NaHS
C. 同物质的量浓度的Na2S、NaClO、CH3COONa溶液,pH最大的是NaClO溶液
D. 同物质的量浓度的H2S、HClO、CH3COOH溶液,酸性最强的是CH3COOH
难度: 中等查看答案及解析
-
下列选项中,微粒的物质的量浓度关系正确的是
A. 0.1 mol/L K2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B. 0.1 mol/L NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
C. 等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)= c(HX)+c(X-)
D. 浓度均为0.1 mol/L的NaHCO3溶液和NaOH溶液等体积混合:c(Na+)+ c(H+)=c(CO32-)+c(OH-)+c(HCO3-)
难度: 困难查看答案及解析
-
下列说法错误的是( )
A. 丙烷与异丁烷互为同系物
B. 相对分子质量相同的物质,不一定互为同分异构体
C. 在分子组成上相差若干个“CH2”原子团的物质互称为同系物
D. 分子式符合 Cn H 2 n 2 的有机物一定是烷烃
难度: 中等查看答案及解析
-
下列各组物质中都属于弱电解质的一组是
A. NH3、SO2、H2O、HI
B. HF、H2O、NH3·H2O、H2SO3
C. BaSO4、Cl2、HClO、H2S
D. NaHSO3、H2O、CO2、H2CO3
难度: 简单查看答案及解析
-
下列表述和说法正确的是
A. 乙烯分子球棍模型:

B. -OH与
都表示羟基
C. 3,3-二甲基-1-戊烯的键线式:
D. 苯的最简式:(CH)6
难度: 简单查看答案及解析
-
常温下,下列说法不正确的是
A. 物质的量浓度相同的NaOH溶液和氨水:c(Na+)>c(NH4+)
B. 物质的量浓度相同的盐酸和醋酸溶液,前者c(OH-)更小
C. 将相同体枳相同物质的量浓度的NaOH溶液和醋酸溶液混合后呈碱性,说明醋酸是弱电解质
D. pH=3的盐酸和pH=11的氨水混合后pH>7,说明氨水是弱电解质
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. HSO3-+H2O
SO32-+OH-
B. Al3++3H2O=3H++ Al(OH)3
C. NaHCO3=Na++ HCO3-
D. H2S
2H++S2-
难度: 简单查看答案及解析
-
与纯水的电离相似,液氨中也存在着微弱的电离:2NH3
NH4++ NH2-,据此判断以下叙述中错误的是( )
A. 液氨中含有NH3、NH4+、NH2-等微粒
B. 一定温度下,液氨中c(NH4+)·c(NH2-)是个常数
C. 液氨的电离达到平衡时:c(NH3)=c(NH4+)=c(NH2-)
D. 只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
难度: 中等查看答案及解析
-
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中通NH3 ⑤向水中加入明矾晶体 ⑥向水中加入NaHCO3固体 ⑦向水中加NaHSO4固体
A. ①③⑥⑦ B. ①③⑥ C. ⑤⑦ D. ⑤
难度: 中等查看答案及解析
-
下列实验能达到预期目的的是
选项
实验内容
实验目的
A
室温下,用pH试纸分别测定浓度均为0.lmol·L-1的的NaClO溶液和CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向AgCl悬浊液中滴入0.lmol·L-1的的NaI溶液,悬浊液变黄
证明相同温度下:Ksp(AgCl)>Ksp(AgI)
C
常温下,测得饱和溶液的pH: NaA>NaB
证明常温下的水解程度:A-<B-
D
酸式滴定管中硫酸液面在20.00mL处,将滴定管中液体全部放出
量取20.00mL硫酸溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式中属于盐类水解反应的是
①NH3+H2O
NH4++OH- ②HCO3-+H2O
H2CO3+OH-
③HCO3-+H2O
H3O++CO32- ④Fe3++3HCO3-
Fe(OH)3↓+3CO2↑
⑤NH4++2H2O
NH3•H2O+H3O+
A. ②④⑤ B. ②③④⑤ C. ①③⑤ D. ①②③⑤
难度: 简单查看答案及解析
-
有机物A的键线式结构为
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的一氯代物只有4种
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
难度: 困难查看答案及解析
-
双键完全共轭(单键与双键相间)的单环多烯烃称为轮烯,[8]轮烯(
)是其中的一种。下列关于该化合物
的说法错误的是( )
A. 与苯乙烯互为同分异构体 B. 能使酸性高锰酸钾溶液褪色
C. 二氯代物有四种 D. 生成 1 mol C8H16 至少需要 4 mol H2
难度: 困难查看答案及解析
-
下列关于苯乙烷(
)的叙述,正确的是
①能使酸性高锰酸钾溶液褪色 ②可以发生加聚反应 ③可溶于水 ④可溶于苯 ⑤能与浓硝酸发生取代反应 ⑥所有原子可能共面
A. ①④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
温度相同、浓度均为0.1mol·L-1的①(NH4)2SO4 ②NH3·H2O ③NH4HSO4 ④NH4NO3 ⑤(NH4)2CO3溶液中的c(NH4+)由大到小的排列顺序是
A. ①⑤③④② B. ⑤①③④②
C. ③②①④⑤ D. ⑤①②④③
难度: 中等查看答案及解析
-
化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是
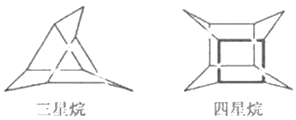
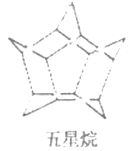
A. 它们之间互为同系物
B. 六星烷的化学式为C18H22
C. 三星烷与丙苯互为同分异构体,四星烷与
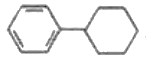 互为同分异构体
互为同分异构体D. 它们的一氯代物均只有两种而三星烷得二氯代物有四种
难度: 中等查看答案及解析
-
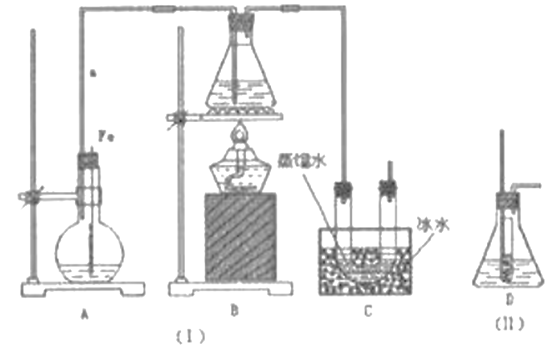
用下列装置完成相关实验,合理的是 ( )
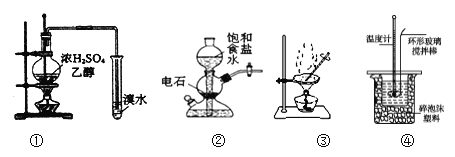
A. 用①制备并检验乙烯 B. 实验室中若需制备较多量的乙炔可用装置②
C. 提纯含苯甲酸钠杂质的粗苯甲酸选择装置③ D. 可用装置④来进行中和热的测定
难度: 中等查看答案及解析
-
室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是
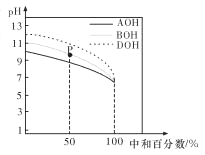
A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
难度: 困难查看答案及解析
-
下列说法不正确的是
A. 将TiCl4溶于水、加热,得到沉淀TiO2·xH2O,继续焙烧可得到TiO2
B. 可采取加热蒸发的方法使FeCl3从水溶液中结晶析出
C. 配制FeCl3溶液时,为了防止溶液出现浑浊,可以向溶液中滴入少量盐酸
D. 为了除去MgCl2酸性溶液中的FeCl3,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量盐酸
难度: 简单查看答案及解析
-
柠檬烯具有良好的镇咳、祛痰、抑菌作用,其结构如图所示。下列关于柠檬烯的说法正确的是
A. 分子式为C10H14
B. 分子中所有碳原子可能都处于同一平面上
C. 属于乙烯的同系物
D. 能发生取代反应和加成反应
难度: 简单查看答案及解析
-
已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol•L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应为
A. 2.8×10-2 mol•L-1 B. 1.4×10-5 mol•L-1
C. 2.8×10-5 mol•L-1 D. 5.6×10-5 mol•L-1
难度: 中等查看答案及解析
-
八氯丁烷的同分异构体有
A. 6 种 B. 8 种 C. 9 种 D. 10 种
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A. 在碱性溶液中:CO32-、K+、S2-、Na+
B. 在含有大量Ba2+的溶液中:NO3-、A1O2-、Na+、HCO3-
C. 水电离出来的c(H+)=10-13mol/L 的溶液:K+、HCO3-、Br+、Ba2+
D. 在中性溶液中:K+、Cl-、Al3+、NO3-
难度: 简单查看答案及解析
-
t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是( )
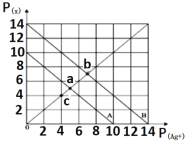
A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. t℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)平衡常数K=10-4
D. t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
难度: 中等查看答案及解析