-
常温下,几种酸的电离平衡常数如下:
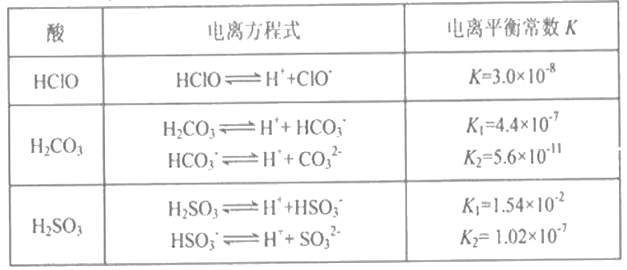
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的①NaClO溶液 ②Na2CO3溶液 ③NaHCO3溶液 ④Na2SO3溶液,pH值由大到小的顺序是____________________。(填序号)
(2)用离子方程式表示NaClO溶液呈碱性的原因是____________________________________________。
(3)0.1mol/L的氯化铵溶液中各离子物质的量浓度由大到小的顺序是___________,只改变下列一个条件,能使c(NH4+)与c(Cl-)比值变大的是______________________。(填标号)
A.加入固体硫酸铵
B.通入少量氯化氢
C.降低溶液温度
D.加入少量固体氢氧化钠
(4)假设25 ℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-6mol/L,则在该温度下此溶液中氨水的电离平衡常数:Kb(NH3·H2O)=_________________________________。
-
已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子,结合质子能力最强的是______________
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是____________;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是__________
A HCN B HClO C C6H5OH D CH3COOH E H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(2)CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为___________mol/L。
-
常温下,0.1 mol·L-1某一元酸(HA)溶液中 =1×10-6,下列叙述正确的是
=1×10-6,下列叙述正确的是
A.加水稀释,溶液的c(OH-)增大
B.此时,HA的电离平衡常数约为10-8
C.溶液中水电离出的H+的物质的量浓度约为10-10 mol·L-1
D.与0.05 mol·L-1NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请回答下列问题:
(1)常温下,物质的量浓度均为0.1mol·L-1的六种溶液
①Na2CO3、②NaCl、③NaOH、④(NH4)2SO4、⑤CH3COONa、⑥NH4NO3 , pH从大到小排列顺序为__________(填序号)。
(2)已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液bL与pH=2的H2SO4溶液aL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3, 则a :b=__________。
(3)现有HA、HB两种酸。室温下用0.1mol· L-1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如下图。
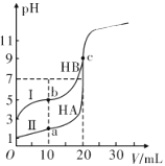
①由图可知;酸性HA______HB,b 点对应的溶液中c(HB)_____c(B-)(填“>”“<”或“=”)。
②室温下HB的电离平衡常数Ka的数量级为________。
-
电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
| 化学式 | CH3COOH | HClO |
| 电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:
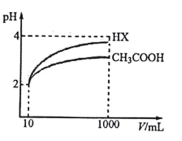
①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
-
常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是
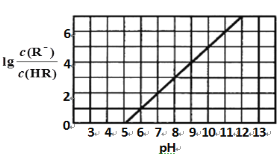
A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
-
已知25℃时部分弱电解质的电离平衡常数数据如表:
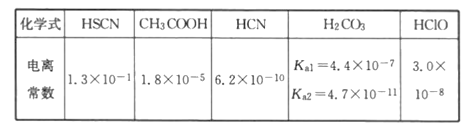
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:Ka1____________________。
(2)物质的量浓度均为0.1mol·L-1的五种溶液:
a.CH3COONa b.Na2CO3 c. NaClO d.NaCN e.NaSCN
pH由大到小的顺序为____________________________(用编号填写)。
(3)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中c(Na+)-c(CN-)=________________mol·L-1(填带入数据后的计算式,不必算出具体数值)。
(4)向NaClO溶液中通入少量的CO2,发生反应的离子方程式为_____________________。
(5)25℃时,0.18mol·L-1醋酸钠溶液的pH约为___________。
-
常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
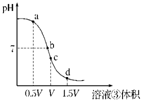
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.
-
(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
-
(1)已知常温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH=________,此酸的电离平衡常数K=________,由HA电离出的H+的浓度约为水电离出的H+的浓度的________倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是________________,向其中加入少量KOH溶液时,发生反应的离子方程式是________________。
②现将0.04 mol·L-1 HA溶液和0.02 mol·L-1 NaOH溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)________c(CN-)(填“<”、“=”或“>”)。
b.若HA为CH3COOH,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是____________________________。





