-
强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(1)△H =-57.3kJ/mol。
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O △H =- Q1kJ/mol
1/2 H2SO4(浓) + NaOH(aq) == 1/2Na2SO4(aq) +H2O(1) △H =- Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H =- Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为
A. Q1=Q2=Q3 B. Q2>Q1>Q3 C. Q2>Q3>Q1 D. Q2=Q3>Q1
难度: 简单查看答案及解析
-
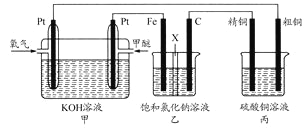
以硫酸铜作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是
①粗铜与直流电源负极相连;
②阴极发生的反应为Cu2++2e-=Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
A. ①③ B. ②④ C. ③④ D. ②③
难度: 中等查看答案及解析
-
等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是
A. c(M+)>c( OH―)> c(A-)>c(H+)
B. c(M+)> c(A-)>c(H+)>c( OH―)
C. c(M+)> c(A-)>c( OH―)>c(H+)
D. c(M+)>c(H+) =c( OH―)+ c(A-)
难度: 中等查看答案及解析
-
设C(s)+CO2(g)
2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)
2NH3(g);ΔH2<0反应速率为v2。
对于上述反应,当温度降低时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
难度: 中等查看答案及解析
-
室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A.0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B.0.1mol/L的硫酸和0.1mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=10的氨水
难度: 中等查看答案及解析
-
将等物质的量K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,经搅拌、静置、过滤。取滤液,用铂电极电解该滤液一段时间。则两个极区析出的氧化产物与还原产物的质量比约为( )
A.35.5∶108 B.108∶35.5
C.8∶1 D.1∶2
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是(Pb相对原子质量207)
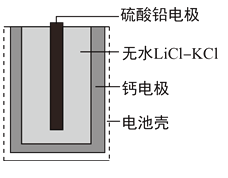
A. 正极反应式:Ca+2Cl--2e-=CaCl2
B. 放电过程中,Li+向负极移动
C. 每转移0.1mol电子,理论上生成20.7gPb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
难度: 中等查看答案及解析