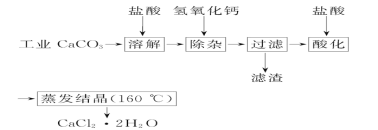
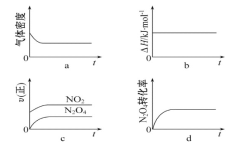
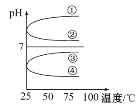
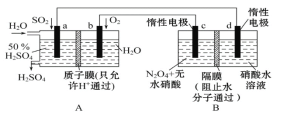
-
已知:25 ℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断正确的是
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C. 25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L的氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
D. 25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
难度: 中等查看答案及解析
-
在下列各溶液中离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Al3+、Cl-、SO42-
B. 含0.1mol/L Fe3+的溶液中:K+、Mg2+、I-、NO3-
C. 含0.1mol/L Ca2+的溶液中:Na+、K+、CO32-、Cl-
D. 室温下pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
难度: 中等查看答案及解析
-
准确量取25.00毫升高锰酸钾溶液,可选用的仪器是
A. 50 mL量筒 B. 10 mL量筒 C. 50 mL酸式滴定管 D. 50 mL碱式滴定管
难度: 中等查看答案及解析
-
有关化学反应的说法,正确的是
A. 自发反应都是放热反应 B. 自发反应都是熵增大的反应
C. 非自发反应在一定条件下能实现 D. 自发反应常温下一定能实现
难度: 中等查看答案及解析
-
实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,最适宜选用的试剂是
A. NaOH溶液 B. Ba(OH)2溶液
C. 盐酸 D. 氨水
难度: 中等查看答案及解析
-
改变反应条件使化学平衡向正反应方向移动时,下列变化中正确的是
A. 生成物浓度一定增大 B. 某生成物的产率可能提高
C. 反应物的转化率一定提高 D. 生成物的物质的量分数一定增大
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 碳酸的电离:H2CO3
2H++CO32-
B. 将金属钠加入水中:2Na+2H2O===2Na++2OH-+H2↑
C. 硫化钠水【解析】
S2-+2H2OH2S↑+2OH-
D. 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-===Al(OH)3↓
难度: 中等查看答案及解析
-
向纯水中加入少量的KHSO4固体(温度不变),则溶液的
A. pH升高 B. c(H+)和c(OH-)的乘积增大
C. 溶液呈中性 D. OH-离子浓度减小
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O
HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
B. 对2HI(g)
H2(g)+I2(g),增大压强可使平衡体系颜色变深
C. 反应CO+NO2
CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动
D. 合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
难度: 中等查看答案及解析
-
用于人造地球卫星的一种高能电池——银锌蓄电池,其电极式反应式为Zn+2OH--2e-======ZnO+H2O Ag2O+H2O+2e-======2Ag+2OH-。据此判断氧化银是
A. 负极,并被氧化 B. 正极,并被还原
C. 负极,并被还原 D. 正极,并被氧化
难度: 中等查看答案及解析
-
向25 ℃时的纯水中通入一定量的HCl气体,当溶液的pH=2时,则由水电离出的c(H+)是
A. 1×10-2 mol·L-1 B. 1×10-8 mol·L-1
C. 1×10-12 mol·L-1 D. 1×10-4 mol·L-1
难度: 中等查看答案及解析
-
下列有关沉淀溶解平衡的说法中,正确的是( )
A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大
B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动
C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小
D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成
难度: 中等查看答案及解析
-
在蒸发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可以得到该物质的固体是( )
A. 氯化镁溶液 B. 硫酸亚铁溶液 C. 碳酸氢钠溶液 D. 硫酸铝溶液
难度: 中等查看答案及解析
-
下列事实能用电化学理论解释的是
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铝片不用特殊方法保存
C. 纯锌与稀硫酸反应时,滴入少量浓H2SO4溶液后速率加快
D. 镀锌铁不如镀锡铁耐用
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
难度: 简单查看答案及解析
-
可逆反应aA(g)+bB(s)
cC(g)+dD(g)在反应过程中,其他条件不变,C的物质的量分数和T或p关系如图所示,下列叙述中正确的是
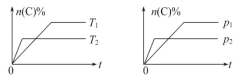
A. 化学方程式化学计量数a<c+d
B. 使用催化剂,C的物质的量分数增加
C. 温度降低,化学平衡向逆反应方向移动
D. 无法根据图像确定改变温度后化学平衡移动方向
难度: 中等查看答案及解析
-
25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH4+)分别为a、b、c(单位为 mol/L),下列判断正确的是
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
难度: 中等查看答案及解析
-
将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
A. ①③⑤⑦⑧ B. ②④⑦ C. ①⑥ D. ②④⑥⑧
难度: 中等查看答案及解析
-
把a,b,c三块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;b、c相连时,c不易被腐蚀。则三种金属的活动性由强到弱的顺序为
A. a>b>c B. a>c>b C. c>b>a D. b>c>a
难度: 简单查看答案及解析
-
在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯同时加入质量不等的锌粒,反应结束后得到等量的氢气,下列说法不正确的是
A. 甲烧杯中酸过量
B. 两烧杯中参加反应的锌等量
C. 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
D. 反应开始后,乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大
难度: 困难查看答案及解析
-
相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO说法正确的是
A. 电离程度:HCN>HClO
B. pH:HClO>HCN
C. 酸根离子浓度:c(CN-)<c(ClO-)
D. 与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
难度: 中等查看答案及解析
-
可逆反应:3A(g)
3B(?)+C(?)(正反应是吸热反应),随着温度的升高,气体平均相对分子质量有减小趋势,则下列判断正确的是
A. B和C可能都是固体 B. B和C一定都是气体
C. 若C为固体,则B一定是气体 D. B和C不可能都是气体
难度: 中等查看答案及解析
-
将0.l mol·L-1 CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液的pH增加 B. CH3COOH物质的量浓度小
C. 溶液的导电能力减弱 D. 溶液中c(OH-)减小
难度: 中等查看答案及解析
-
在密闭容器中,进行反应X(g)+3Y(g)
2Z(g),达到平衡后,其他条件不变,只增加X的量,下列叙述中不正确的是
A. 正反应速率增大,逆反应速率减小 B. X的转化率变小
C. Y的转化率变大 D. 正、逆反应速率都增大
难度: 中等查看答案及解析
-
用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度的是
A. AgNO3 B. Na2SO4 C. CuCl2 D. KCl
难度: 中等查看答案及解析
-
常温下,把0.02 mol/L CH3COOH(Ka=1×10-5 mol/L)溶液和0.01 mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是
A. c(CH3COO-)>c(Na+) B. c(CH3COOH)>c(CH3COO-)
C. c(H+)<c(OH-) D. c(CH3COOH)+c(CH3COO-)=0.02 mol/L
难度: 中等查看答案及解析
-
用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
A. ④⑤ B. ①④ C. ②③⑤ D. ②⑤
难度: 中等查看答案及解析
-
某同学为了使反应2HCl + 2Ag
2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
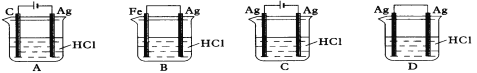
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
向10 mL pH=12的NaOH溶液中加入10 mL某酸,再滴入几滴甲基橙,溶液呈红色,则这种酸可能是
A. pH=2的硫酸 B. 0.01 mol·L-1的甲酸
C. pH=2的醋酸 D. 0.01 mol·L-1的硝酸
难度: 困难查看答案及解析
-
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
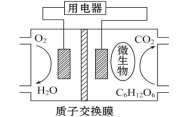
A. 该电池能够在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-====6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1 mol氧气,理论上能生成CO2气体22.4L
难度: 困难查看答案及解析
-
对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是
A. 以石墨为电极,电解含甲基橙的0.1 mol/L硫酸溶液
B. 以铜为电极,电解1 mol/L硫酸溶液
C. 以石墨为电极,电解含酚酞的饱和食盐水
D. 以石墨为电极,电解1 mol/L溴化钾溶液
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是
A. 稀醋酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)====H2O(l) ΔH =-57.3 kJ·mol-1
B. 氢气的标准燃烧热为285.5 kJ·mol-1, 则水分解的热化学方程式:2H2O(l)====2H2(g)+O2(g) ΔH =285.5 kJ·mol-1
C. 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。 则Fe(s)+S(s)====FeS(s) ΔH =-95.6 kJ·mol-1
D. 已知2C(s)+O2(g)=2CO(g)ΔH =-221 kJ·mol-1,则可知C的标准燃烧热为110.5 kJ·mol-1
难度: 中等查看答案及解析
-
常温下,将pH=3的H2SO4和pH=12的NaOH溶液混合,当混合溶液的pH=10时,强酸和强碱的体积之比为
A. 1∶9 B. 9∶1 C. 10∶1 D. 1∶10
难度: 中等查看答案及解析
-
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是
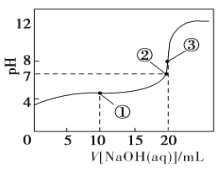
A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
难度: 困难查看答案及解析
-
下列叙述正确的是
A. 焓减或熵增的过程在任何条件下都能自发进行
B. 向饱和AgCl溶液中加入盐酸,Ksp变大
C. 将饱和FeCl3溶液滴入到沸水中可制备Fe(OH)3胶体
D. pH=5的CH3COOH溶液加水稀释1 000倍后pH=8
难度: 中等查看答案及解析