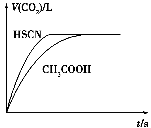
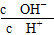-
下列溶液一定呈中性的是 ( )。
A.c(H+)=c(OH-)=10-6 mol·L-1的溶液
B.pH=7的溶液
C.使石蕊试液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液
难度: 中等查看答案及解析
-
下列说法正确的是( )。
A.0.1 mol·L-1的醋酸溶液加水稀释,
减小
B.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少
C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大
D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是 ( )。
A.在蒸馏水中滴加浓H2SO4,KW不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
难度: 中等查看答案及解析
-
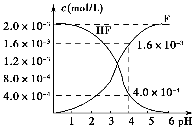
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是 ( )。
A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32—)+c(OH-)+c(Cl-)
B.pH=4的溶液中:c(H2CO3)+c(HCO3—)+c(CO32—)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3—)=c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32—)>c(HCO3—)>c(H2CO3)
难度: 中等查看答案及解析
-
25 ℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl
Ag2SO4
Ag2S
AgBr
AgI
1.8×10-10
1.4×10-5
6.3×10-50
7.7×10-13
8.51×10-16
下列说法正确的是 ( )。
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不可能得到黑色沉淀
C.在5 mL 1.8×10-5 mol·L-1的NaCl溶液中,加入1滴(1 mL约20滴)0.1 mol·L-1的AgNO3溶液,不能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成
难度: 中等查看答案及解析
-
50 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )。
A.pH=4的醋酸中:c(H+)=4.0 mol·L-1
B.饱和小苏打溶液中:c(Na+)=c(HCO3—)
C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1
难度: 中等查看答案及解析
-
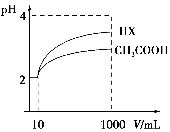
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )。
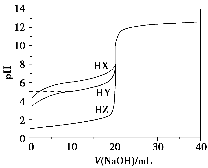
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时c(H+)=
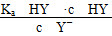 +c(Z-)+c(OH-)
+c(Z-)+c(OH-)难度: 中等查看答案及解析
-
下列有关物质浓度关系的描述,正确的是 ( )。
A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH-)=c(H+)
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(CO32—)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3)
难度: 困难查看答案及解析
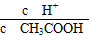 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.