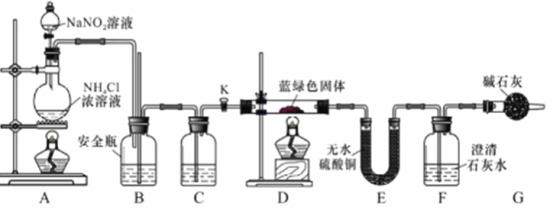
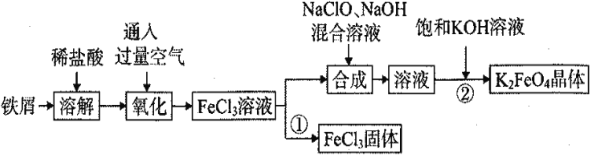
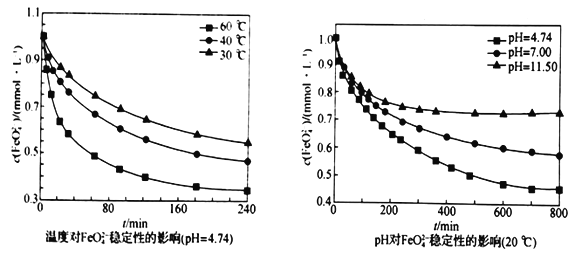
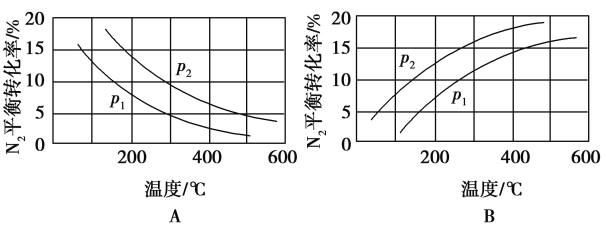
-
化学与生活密切相关。下列说法不正确的是
A. 流感疫苗需要冷冻保存的目的是防止蛋白质变性
B. 久置的青菜菜叶变黄与用SO2 漂白的纸张变黄的原理相同
C. 大力推广使用太阳能路灯,有利于节能减排
D. 被蜜蜂或蚂蚁蜇咬,可在伤口除抹肥皂水消肿止疼
难度: 中等查看答案及解析
-
下列说法错误的是
A. 乙烷在光照的条件下能与溴水发生取代反应
B. 乙烯可以用作生产食品包装材料的化工原料
C. 室温下,乙醇在水中的溶解度大于溴乙烷
D. 乙酸与甲酸甲酯互为同分异构体
难度: 中等查看答案及解析
-
下列实验对应的现象以及结论均正确的是
选项
实验
现象
结论
A
向装有溴水的分液漏斗中加入裂化汽油,充分振荡,静置
上层溶液为橙色
裂化汽油可萃取溴
B
将钠块加入盛有无水乙醇的烧杯中
有气泡产生
生成的气体是H2
C
溴乙烷和NaOH溶液混合后加热,再加入硝酸银溶液
有白色沉淀生成
溴乙烷分子中存在溴原子
D
分别向相同浓度的ZnSO4溶液和
CuSO4溶液中通入H2S
前者无现象,后者有黑色沉淀生成
Ksp(ZnS)<Ksp(CuS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 将1molCl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100 g CaCO3晶体和136 g KHSO4晶体中含有的离子数分别为2 NA 和3 NA
C. 3mol Fe在纯氧中完全燃烧转移的电子数为8NA
D. 已知:N2(g)+3H2(g)
2NH3 (g) ΔH=-92 kJ·mol-1,当有46 kJ热量放出时,形成NA个共价键
难度: 中等查看答案及解析
-
A、B、C、D、E五种短周期元素,其中A是地壳中含量最多的元素;C元素的单质存在于火山喷发口附近或地壳的岩层里;E原子的电子总数等于其电子层数的3倍;D的一种原子核中没有中子;A、B、C三种元素的族序数之和为16。下列说法错误的是
A. D与E可形成既含极性键又含非极性键的分子
B. B的最高价氧化物为酸性氧化物,不能与任何酸反应
C. B、C、E三种元素的最高价氧化物对应的水化物中,B的酸性最弱
D. A、C、D中两种或三种元素形成的钠盐溶液可显酸性、中性或碱性
难度: 中等查看答案及解析
-
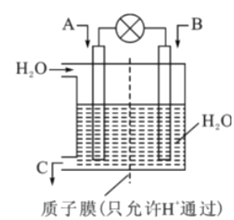
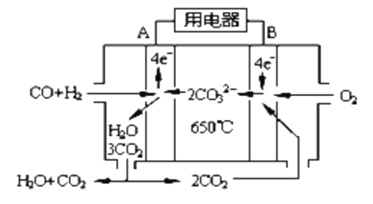
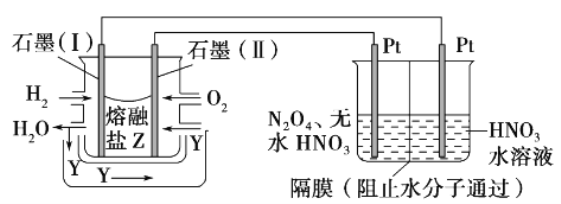
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是
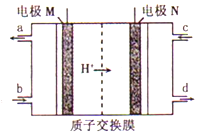
A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
难度: 困难查看答案及解析
-
下列有关电解质溶液的叙述中错误的是
A. 在T℃时,某溶液中c(H+)=
,则该溶液一定显中性
B. 25℃时,如弱酸与强碱溶液的pH之和等于14,则它们等体积混合液呈酸性
C. 常温下,pH相等的NaOH溶液与氨水稀释后保持pH仍然相等,则氨水加水多
D. 体积和pH均相等的HCl与CH3COOH溶液分别与足量锌粒反应,放出H2一样多
难度: 中等查看答案及解析