-
由一价离子组成的四种盐:AC、BD、AD、BC的1 mol·L-1的溶液,在室温下前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7,则下列说法正确的是( )
A
B
C
D
碱性
AOH>BOH
AOH<BOH
AOH>BOH
AOH<BOH
酸性
HC>HD
HC>HD
HC<HD
HC<HD
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A. 2H++2e-=H2 B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 原电池是把电能转化为化学能的装置
B. 原电池中电子流出的一极是正极,发生氧化反应
C. 原电池的两极发生的反应均为氧化还原反应
D. 形成原电池后,原电池中的阳离子向正极移动
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A. 强电解质只能在水溶液里完全电离
B. 固体氯化钠不导电,氯化钠是非电解质
C. CO2的水溶液能导电,但CO2是非电解质
D. 氯水能导电,所以Cl2是电解质
难度: 中等查看答案及解析
-
准确量取25.00mL高锰酸钾溶液,可选用的仪器是
A. 25mL酸式滴定管 B. 有刻度的50mL烧杯
C. 25mL碱式滴定管 D. 25mL量筒
难度: 简单查看答案及解析
-
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )。
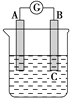
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
难度: 中等查看答案及解析
-
下列有关反应:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ/mol的描述不正确的是
A. 该反应为放热反应
B. 该反应中每4molNH3(g)被氧化,放出905 kJ热量
C. 生成物的总能量小于反应物的总能量
D. 生成物的总键能小于反应物的总键能
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1, 则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B. CO(g)的燃烧热是283 kJ/mol,则2CO(g)+O2(g)==2CO2(g)反应的ΔH=-566 kJ·mol-1
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
难度: 中等查看答案及解析
-
已知在25℃时下述反应的有关数据:
C(s)+1/2 O2(g)=CO(g) △H1 =-110.5 kJ• mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ• mol-1
则C(s)+CO2(g)=2CO(g) 的△H 为
A. +283.5 kJ• mol-1 B. +172.5 kJ• mol-1
C. -172.5 kJ• mol-1 D. -504 kJ• mol-1
难度: 简单查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O
CH3COOH+4H+。下列有关说法正确的是 ( )
A. 电池反应的化学方程式为CH3CH2OH+O2
CH3COOH+H2O
B. 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C. 检测时,电解质溶液中的H+向负极移动
D. 正极上发生的反应为O2+4e-+2H2O
4OH-
难度: 中等查看答案及解析
-
化学反应C(s)+H2O(g)
CO(g)+H2(g) △H>0 达到平衡,下列叙述正确的是
A. 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 加入固体炭,平衡向正反应方向移动
C. 加入水蒸气,平衡向逆反应方向移动
D. 扩大容器的容积,平衡向正反应方向移动
难度: 中等查看答案及解析
-
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是 ( )
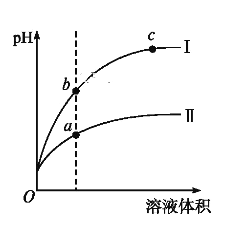
A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点Kw的数值比c点Kw的数值大
D. b点H+的浓度大于a点H+的浓度
难度: 中等查看答案及解析
-
25℃时,将稀氨水逐滴加入到稀盐酸中,当溶液的pH=7时,下列关系正确的是
A. c(NH4+) = c(Cl-) B. c(NH4+)=2c(Cl-)
C. 2c(NH4+)=c(Cl-) D. c(OH-)+c(Cl-) = c(H+)
难度: 简单查看答案及解析
-
在0.1 mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡下列叙述正确的是
A. 加入水时,平衡逆向移动
B. 加入少量NaOH固体,平衡正向移动
C. 加入少量0.1 mol/L 盐酸,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡正向移动
难度: 中等查看答案及解析
-
已知25 ℃时水的离子积为Kw=1.0×10-14,35 ℃时水的离子积为Kw=2.1×10-14。下列说法中正确的是 ( )
A. 水中的c(H+)随温度的升高而降低
B. 25 ℃时水呈中性,35 ℃时水呈酸性
C. 水的电离过程是吸热过程
D. 一定温度下,向水中加入酸或碱时,水的离子积将发生变化
难度: 中等查看答案及解析
-
室温下,在pH=12的NaOH溶液中,由水电离生成的c(OH-)为
A. 1.0×10-7 mol·L-1 B. 1.0×10-6 mol·L-1
C. 1.0×10-2 mol·L-1 D. 1.0×10-12 mol·L-1
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
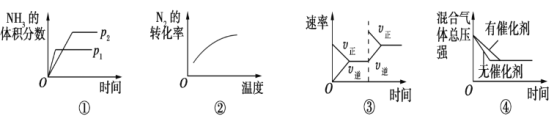
A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
难度: 中等查看答案及解析
-
现有等浓度的下列溶液:①醋酸;②硫酸氢钠;③醋酸钠;④碳酸;⑤碳酸钠;⑥硫酸钠。按溶液pH由小到大排列正确的是 ( )
A. ④①②⑤⑥③ B. ⑥①②④③⑤
C. ②①④⑥③⑤ D. ①④②③⑥⑤
难度: 中等查看答案及解析
-
有关AgCl沉淀的溶解平衡的说法正确的是
A. AgCl沉淀的生成和溶解仍在不断进行,但速率相等
B. AgCl不溶于水,溶液中没有Cl-和Ag+
C. 升高温度,AgCl的溶解度不变,Ksp不变
D. 向AgCl饱和溶液中加入NaCl固体,AgCl的Ksp变小
难度: 中等查看答案及解析
-
向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
难度: 中等查看答案及解析
-
控制适合的条件,将反应
设计成如右图所示的原电池。下列判断不正确的是( )
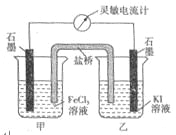
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上
被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入
固体,乙中的石墨电极为负极
难度: 困难查看答案及解析
-
下列不能用于金属防腐处理的是
A. 在海轮的船体上涂油漆 B. 在海轮的船体上镶锌块
C. 在海轮的船体上镶铜块 D. 在海轮的船体上镀上一层耐腐蚀的金属
难度: 简单查看答案及解析
-
用惰性电极电解下列溶液,一段时间后,再加入一定量的另一种物质(括号内),溶液能与原来溶液完全一样的是
A. CuCl2[CuSO4] B. NaOH [NaOH]
C. NaCl [HCl] D. CuSO4[Cu(OH)2]
难度: 中等查看答案及解析
-
以惰性电极电解CuSO4溶液,若阳极上产生的气体的物质的量为0.010 mol,则阴极上析出Cu的质量为
A. 0.64 g B. 1.28 g C. 2.56 g D. 5.12g
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e— +2OH—= Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO42-+ 4H2O
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
难度: 简单查看答案及解析