-
化学在生活中有着广泛的应用,下列对应关系正确的是
选项
化学性质
实际应用
A
Al2(SO4)3和苏打溶液反应
泡沫灭火器灭火
B
油脂在酸性条件下的水解反应
工业生产中制取肥皂
C
醋酸具有酸性
食醋除水垢
D
SO2具有漂白性
可用于食品增白
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 苯和液溴在光照条件下生成溴苯
B. C4H2Cl8有8种同分异构体(不含立体异构)
C. 以淀粉为原料可制取乙酸乙酯
D. 木材纤维和土豆淀粉遇碘水均显蓝色
难度: 中等查看答案及解析
-
下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是
选项
实验器材
相应实验
A
天平(带砝码)、100mL容量瓶、烧杯、胶头滴管
配制100mL1.00mol /L NaCl溶液
B
烧杯、环形玻璃搅拌棒、碎泡沫塑料、硬纸板
中和反应反应热的测定
C
酸/碱式滴定管、滴定管夹、烧杯、锥形瓶、铁架台
实验测定酸碱滴定曲线
D
三脚架、酒精灯、坩埚、坩埚钳、镊子、泥三角
钾在空气中燃烧
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
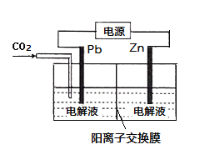
Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。如图用该水激活电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是
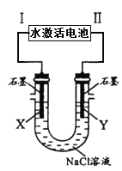
A. II为正极,其反应式为Ag+ + e– =Ag
B. 水激活电池内Cl–由正极向负极迁移
C. 每转移1 mole-,U型管中消耗0. 5mol H2O
D. 开始时U型管中Y极附近pH逐渐增大
难度: 中等查看答案及解析
-
某溶液中除水电离出的OH-、H+之外含Na+、Fe2+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4 种,这4种离子的物质的量均为0.1 mol。若向该溶液中加入少量稀硫酸,无沉淀生成但有气泡产生。下列说法错误的是
A. 该溶液中肯定不含Ba2+
B. 若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种
C. 若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体
D. 该溶液中除水电离出的OH-、H+之外所含离子是Na+、Fe2+、SO42-、NO3-
难度: 中等查看答案及解析
-
a、b、c、d为原子序数依次减小的短周期主族元素,b与c同周期且相邻。物质X、Y、Z均由其中三种元素组成,且为中学常见强电解质,可发生反应X+Y=Z+H2O。下列叙述错误的是
A. a的原子半径是这些元素中最大的 B. b与其他三种元素均可形成至少两种二元化合物
C. c与d形成的化合物具有还原性 D. d与其他三种元素形成的二元化合物中其化合价均为+1
难度: 中等查看答案及解析
-
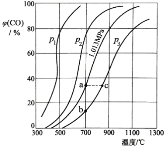
用AG表示溶液酸度:
。在室温下,用 0.1mol•L-1的NaOH溶液滴定20.00mL 0.1mol•L-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
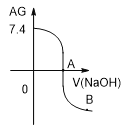
A. 0.1mol•L-1的CH3 COOH溶液的pH=3.4
B. A点加入的NaOH溶液的体积为20.00mL
C. 滴定过程中,c(CH3COO-)/c(H+)逐渐减小
D. B点溶液中可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+)
难度: 中等查看答案及解析

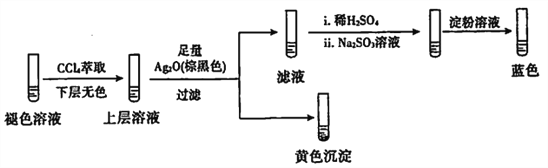
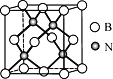
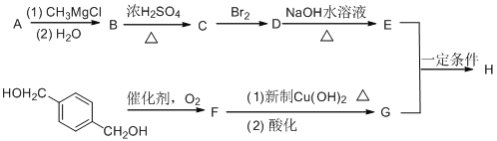
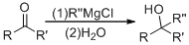
 的符合下列条件的同分异构体有____种
的符合下列条件的同分异构体有____种