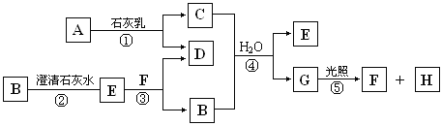
-
下列化学用语表示正确的是
A. 次氯酸的结构式:H—Cl—O B. 氮气的电子式为:
C. 氯化氢的电子式为
D. CO2 的结构式:O=C=O
难度: 简单查看答案及解析
-
我国在全球最先发现天然金属铀。下列对铀元素的一种核素
U,这里的“235”是指该原子的
A. 质量数 B. 中子数 C. 电子数 D. 质子数
难度: 简单查看答案及解析
-
下列变化过程中,没有破坏化学键的是
A. 氯化镁熔化 B. 冰融化成水 C. 氯化氢溶于水 D. 电解水
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A. 当反应物断键吸收的的总能量比生成物成键释放的总能量高时,为放热反应
B. 需要加热才能发生的反应一定是吸热反应
C. 在100KPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能,可知石墨比金刚石稳定
D. 化学反应中能量变化的大小与反应物的质量多少无关
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值,下列说法中不正确的是
A. 1mol NH4+含有的质子总数为 10 NA
B. 7.8g 过氧化钠含有的离子总数为 0.3NA
C. 通常状况下,40g 2H218O2含有的电子总数为18NA
D. 3.2g O2、O3 混合物中所含氧原子一定是 0.2NA
难度: 中等查看答案及解析
-
下列物质中既含有离子键又含有共价键的是( )
A. MgCl2 B. NaOH C. H2O2 D. H2SO4
难度: 简单查看答案及解析
-
下列说法中正确的组合是
①氢元素有三种核素H、D、T,它们互称为同素异形体
②1 mol酸和1 mol碱发生中和反应生成水所释放的热量叫中和热
③化学反应过程包括旧化学键断裂和新化学键形成的过程
④燃煤发电的能量转化关系为化学能→热能→机械能→电能
⑤铅蓄电池是汽车上使用最多的二次电池
⑥碱性锌锰电池属于二次电池
⑦可在周期表金属和非金属的分界处寻找半导体材料,如硅、锗等
A. ①②③④⑤⑥⑦ B. ③④⑤⑦ C. ①③④⑤⑥ D. ②③④⑦
难度: 中等查看答案及解析
-
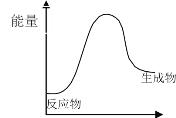
下列反应中,符合下图所示能量变化的氧化还原反应是
A. Ba(OH)2·8H2O 与NH4Cl固体混合
B. 盐酸与氢氧化钠的反应
C. 高温条件下碳粉与二氧化碳的反应
D. 高温条件下铝与氧化铁的铝热反应
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A. 元素X 的简单气态氢化物的热稳定性比W的弱
B. 元素W 的最高价氧化物对应水化物的酸性比Z的弱
C. 原子半径的大小顺序: rY >rZ >rW >rX
D. 化合物YX、ZX2、WX3 中化学键的类型相同
难度: 中等查看答案及解析
-
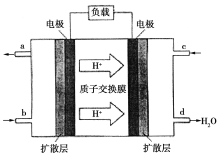
a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b 相连时,电流由a经导线流向b,c、d相连时,电子由d到c;a、c相连时,a极上产生大量气泡,b、d相连时,H+移向d极,则四种金属的活动性顺序由强到弱的顺序为
A. a>b>c>d B. a>c>d>b C. c>a>b>d D. b>d>c>a
难度: 中等查看答案及解析
-
下列实验事实的解释正确的是
选项
实验事实
A
H2O的沸点高于H2S
O的非金属性比S强
B
将打磨过的表面和大小相同的镁条和铝条同时插入盐酸中,镁条表面产生气泡快
镁的金属性强于铝
C
HCl溶于水,能电离出H+、Cl-
HCl为离子化合物
D
HBr的酸性强于HCl的酸性
Br的非金属性比Cl强
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对于反应Zn+H2SO4===ZnSO4+H2↑,下列叙述不正确的是
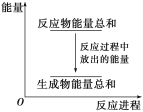
A. 反应过程中能量关系可用上图表示
B. 若将该反应设计成原电池,锌为负极,碳为正极,稀硫酸溶液做电解质
C. 若设计为原电池,当有32.5 g锌溶解,负极放出11.2 L气体(标准状况下)
D. 若设计为原电池,负极有电流流入
难度: 中等查看答案及解析
-
下列选项描述的过程能实现化学能转化为电能的是
A. 太阳能发电

B. 电池充电
C. 风力发电

D. 氢氧燃料电池放电

难度: 简单查看答案及解析