-
古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是
A.野火烧不尽,春风吹又生
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.粉身碎骨浑不怕,要留青白在人间
D.爆竹声中一岁除,春风送暖人屠苏
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g) △H>0,下列图象中正确的是

难度: 中等查看答案及解析
-
下列过程中,没有明显实验现象的是
A.向Fe(NO3)2溶液中滴加稀硫酸
B.将HCl通入NaAlO2溶液中
C.加热溶有SO2的品红溶液
D、向碳酸氢钠溶液中滴加氢氧化钠溶液
难度: 中等查看答案及解析
-
下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是
A.Na+、Al3+、Cl-、OH-(5:2:4:4)
B.NH4+、Ba2+、OH-、Cl-(1:1:1:2)
C.Fe3+、Na+、Cl-、S2-(1:2:3:1)
D.K+、H+、I-、NO3-(1:1:1:1)
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O
B.碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O
C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2
D.用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH-
难度: 中等查看答案及解析
-
心脏起搏器一般是给心跳缓慢的病人使用。某种类型的心脏起搏器工作时发生下列反应:4Li+2SOC12 =4LiC1+S+SO2,下列有关判断正确的是
A.还原剂只有锂
B.SOC12中每个原子都达到8电子稳定结构
C.氧化产物包括LiCl和SO2
D.生成1. 12 LSO2时,反应转移电子为0.2 mol
难度: 中等查看答案及解析
-
在一定温度下,可逆反应A(g) +3B(g)
2C(g)达到平衡的标志是
A.A,B,C的分子数之比为1:3:2
B.C生成速率与A生成速率相等
C.单位时间内生成n molA同时3n mo1B
D.A,B、C的浓度不再变化
难度: 简单查看答案及解析
-
下列实验操作正确且能达到预期目的的是
实验目的
操作
①
比较水和乙醇中羟基氢的活泼性强弱
用金属钠分别与水和乙醇反应
②
欲证明CH2=CHCHO中含有碳碳双键
滴入KMnO4酸性溶液,看紫红色是否褪去
③
欲除去苯中混有的苯酚
向混合液中加入浓溴水,充分反应后,过滤
④
证明SO2具有漂白性
将SO2通入酸性KMnO4溶液中
⑤
比较确定铜和镁金属活泼性强弱
用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液
⑥
确定碳和硅两元素非金属性强弱
测同温同浓度Na2CO3和Na2SiO3水溶液的pH
A.①④⑤ B.②③⑤ C.①②③④⑤⑥ D.①⑤⑥
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,16 g O2和32g O3的混合物中,含有O原子数目为3NA
B.标准状况下,1 mol Na2O和1 mol Na2O2的混合物中,含有离子总数为7NA
C.1 mol NaBH4中离子键的数目为2NA
D.在K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为
NA
难度: 中等查看答案及解析
-
为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是
选项
被提纯的物质(杂质)
除杂试剂
分离方法
A
NH3(H2O)
浓硫酸
洗气
B
H2O(Br2)
CCl4
萃取分液
C
KCl固体(I2)
KOH溶液
加热
D
氯化镁溶液(氯化亚铁)
氢氧化钠溶液
过滤
难度: 中等查看答案及解析
-
室温下,0.1 mol/L的某二元酸H2A溶液中,溶液中可能存在的含A粒子(H2A、HA一、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是
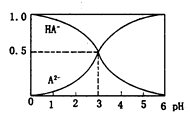
A.H2A的电离方程式:H2A
H十+HA-
B.pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=l:100
C.等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:[c(Na+))c(HA-)>c(A2-)
D.Na2A溶液必存在c(OH一)=c(H+)+c(HA-)十2c(H2A),各粒子浓度均大0
难度: 困难查看答案及解析
-
红曲素是一种食品着色剂的主要成分,其结构简式如图所示。下列有关红曲素的说法正确的是
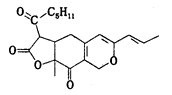
A.红曲素含有两种含氧官能团
B.红曲素分子式为C21H25O5
C.红曲素能使酸性高锰酸钾溶液褪色
D.lmol红曲素最多能与2 mol NaOH反应
难度: 中等查看答案及解析
-
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生且溶液不变蓝,下列叙述正确的是
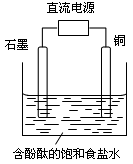
A.铜电极上发生还原反应
B.石墨电极附近溶液呈红色
C.溶液中的Na+向石墨电极移动
D.铜电极附近观察到黄绿色气体
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
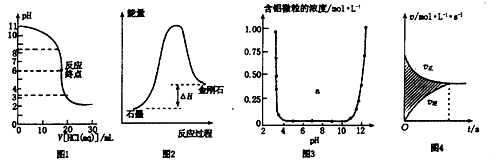
A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线
B.图2所示,石墨的熔点比金刚石低
C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕
难度: 中等查看答案及解析
-
下列图中的实验方案,能达到实验目的的是
A
B
C
D
实验
方案
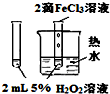
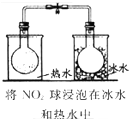
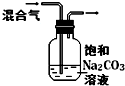
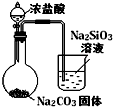
实验
目的
验证FeCl3对H2O2分解反应有催化作用
探究温度对平衡2NO2→N2O4的影响
除去CO2气体中混有的SO2
比较HCl、H2CO3和H2SiO3的酸性强弱
难度: 中等查看答案及解析
-
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝.
下列判断不正确的是
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性
D.实验③证明氧化性:Cr2O72->I2
难度: 中等查看答案及解析
-
短周期元素A、B、C、D、E原子序数依次增大,其中A、C同主族,B、E同主族,A的最外层电子数与次外层电子数相等,E是太阳能转化为电能的常用材料,则下列说法正确的是
A.最高价氧化物对应水化物碱性强弱:A>C
B.C、D的简单阳离子均可促进水的电离
C.B、E的最高价氧化物具有相似的物理性质和化学性质
D.含D的盐溶于水一定显酸性
难度: 中等查看答案及解析
-
常温下有以下体积相同的四种溶液:①pH=3的CH3COOH溶液②pH=3的盐酸③pH=11的氨水④pH=11的NaOH溶液。下列说法正确的是
A.②和③混合,所得混合溶液的pH大于7
B.③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④
C.①与②分别与足量镁粉反应,生成H2的量:①<②
D.若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>②
难度: 中等查看答案及解析
-
下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
难度: 中等查看答案及解析
-
下列事实一定能证明HNO2是弱电解质的是
①常温下 NaNO:溶液的pH大于7
②HNO2不稳定,受热易分解
③HNO2和NaCl不能发生反应
④常温下0.1 mol·L一1HNO2溶液的pH=2.1
⑤常温下pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合,pH小于7
⑥常温下pH=2的HNO2溶液稀释至100倍,pH约为3.1
A.①④⑥ B.①②④⑤⑥ C.①④⑤⑥ D.全部
难度: 中等查看答案及解析
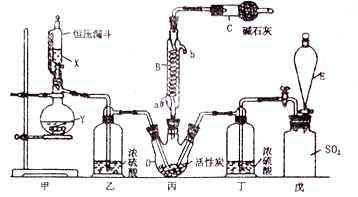
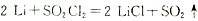 ,则电池工作时,正极的电极反应式为是
,则电池工作时,正极的电极反应式为是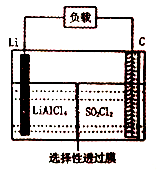

 ,Na2S2O3标准溶液的消耗量为20 mL。
,Na2S2O3标准溶液的消耗量为20 mL。
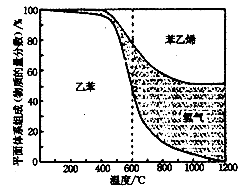
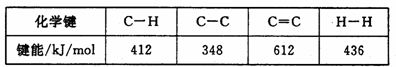
 ,Si3N4属于原子晶体,在上述反应中氧化剂为
,Si3N4属于原子晶体,在上述反应中氧化剂为