-
在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入 1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为
A. 0.15mol/L B. 0.3mol/L C. 0.225mol/L D. 无法计算
难度: 简单查看答案及解析
-
下列组合不能实现喷泉实验的是
A. NO和水 B. CO2和NaOH溶液 C. HCl和水 D. Cl2和NaOH溶液
难度: 中等查看答案及解析
-
某周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数是( )
A. 只有x+1 B. 可能是x+8或x+18
C. 可能是x+2 D. 可能是x+1或x+11或x+25
难度: 中等查看答案及解析
-
以下性质的比较中,错误的是( )
A. 酸性:H2CO3>H2SiO3>Al(OH)3
B. 熔点:K>Na >Li
C. 热稳定性:HF>HCl>H2S
D. 碱性:KOH>NaOH>Mg(OH)2
难度: 简单查看答案及解析
-
已知短周期元素的四种离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述中正确的是
A. 原子序数:D>C>B>A
B. 原子半径:B>A>C>D
C. 离子半径:C3->D->A2+>B+
D. 氧化性:A2+>B+,还原性:C3-<D-
难度: 中等查看答案及解析
-
铜有两种天然同位素
Cu 和
Cu ,参考铜的相对原子质量(63.5),估算
Cu的原子个数百分含量约是
A. 20% B. 25% C. 50% D. 75%
难度: 简单查看答案及解析
-
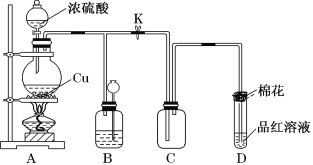
将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A. 反应剧烈程度,两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少
难度: 简单查看答案及解析
-
有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16.三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子.有关判断不正确的是( )
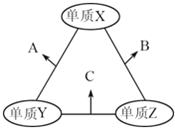
A. X元素位于ⅥA族 B. A不能溶解于B中 C. B的沸点高于C的沸点 D. A和C不可能发生氧化还原反应
难度: 中等查看答案及解析
-
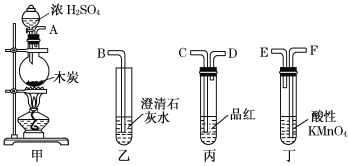
用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
A.
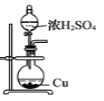 制取二氧化硫气体
制取二氧化硫气体B.
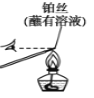 检验溶液中是否有钾离子
检验溶液中是否有钾离子C.
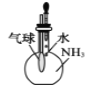 验证氨气极易溶解于水
验证氨气极易溶解于水D.
 加热氢氧化钠固体
加热氢氧化钠固体难度: 简单查看答案及解析
-
某同学设计如下微型实验装置用以验证SO2的性质,通过分析实验,下列结论表达不正确的是( )

A. a棉球褪色,验证SO2具有漂白性
B. b棉球褪色,验证SO2具有酸性氧化物的性质
C. c棉球蓝色褪去,验证SO2具有还原性
D. 只能用烧碱溶液吸收尾气
难度: 中等查看答案及解析
-
实验室中某些气体的制取.收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
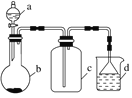
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
图示为含同一种元素的a、b、c、d、e五种物质的转化关系.其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应水化物,则a不可能是(已知CH4高温时可发生分解生成C、H2)
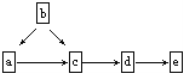
①F2 ②N2 ③C ④S
A. 只有① B. ②和④ C. ③和④ D. ①和③
难度: 中等查看答案及解析
-
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增。Z的+2价阳离子电子层结构与氖相同,X、M同主族,Y在同周期主族元素中原子半径最大。Y和M可以形成Y2M型化合物。下列有关说法错误的是( )
A. X与Y能形成两种化合物
B. 简单氢化物的稳定性:N>M
C. 原子半径:r(Y)>r(M)>r(X)
D. Y、Z、N的最高价的氧化物的水化物两两之间能发生反应
难度: 中等查看答案及解析
-
标况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散)
A. 此反应中水既不是氧化剂又不是还原剂
B. 试管内溶液中溶质的物质的量浓度为1/22.4mol/L
C. 溶液体积占试管容积的三分之二
D. 若将试管中的气体换为氯化氢或者氨气,则水充满试管
难度: 困难查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A. ②③④ B. ②③④⑤ C. ①③④ D. ①②③④
难度: 中等查看答案及解析
-
将一定量的锌与浓度为18.5mol/L的100mL浓硫酸充分反应后,锌完全溶解,同时生成26.88L标准状况下的气体,反应后测得溶液中氢离子浓度为1.0mol/L,则生成的气体的物质的量之比为
A.n(SO2)/n(H2)=1/1 B.n(SO2)/n(H2)=4/1
C.n(SO2)/n(H2)=1/4 D.n(SO2 )/n(H2)=3/2
难度: 困难查看答案及解析