-
化学与生活、生产和社会可持续发展密切相关。下列说法正确的是
A. 高纯二氧化硅可用作计算机芯片的材料
B. 硅胶、铁粉均可作为食品包装中的抗氧化剂
C. 氯化铝是工业上电解法治炼金属铝的原料
D. “地沟油”可用来制肥皂和生物柴油
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 水、乙醇、乙酸都属于弱电解质
B. 苯与氯气生成
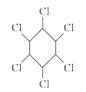 的反应属于取代反应
的反应属于取代反应C. 分子式为C9H12的芳香烃共有8种
D. 淀粉、油脂、蛋白质都属于高分子化合物
难度: 简单查看答案及解析
-
实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取C12并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如下图所示:
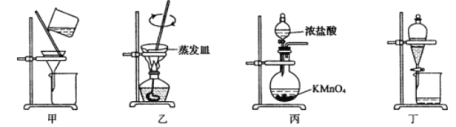
下列叙述正确的是
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备用于氧化过滤液中Br-的Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X、Y、Z原子最外层的电子数之和与W原子最外层的电子数相等,X的最低负价为-4,Y的周期数是族序数的3倍。下列说法正确的是( )
A. 原子半径:Y>Z>X
B. Y的最高价氧化物对应的水化物的碱性比Z的弱
C. W的氧化物对应的水化物的酸性一定比X的强
D. W分别与X、Z形成的化合物所含的化学键类型相同
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,36g18O2中所含的中子数为16NA
B. 8.0 g Cu2S和CuO的混合物中含有的铜原子数为0.1NA
C. 电解饱和食盐水时,阳极生成22.4L气体时,转移的电子数为2NA
D. 室温下向1LpH=1的醋酸溶液中加水,所得溶液中H+数目小于0.1NA
难度: 中等查看答案及解析
-
电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
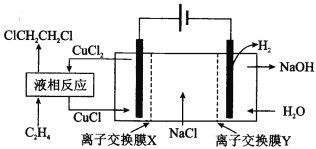
A. 该装置工作时,化学能转变为电能
B. CuCl2能将C2H4还原为 l , 2-二氯乙烷
C. X、Y依次为阳离子交换膜、阴离子交换膜
D. 该装置总反应为CH2CH2 + 2H2O + 2NaCl
H2 + 2NaOH + ClCH2CH2Cl
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论错误的是
操作
现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体
浓硫酸具有脱水性和强氧化性
B
向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液
溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成
Fe2+催化H2O2分解产生O2
C
铝片先用砂纸打磨,再加入到浓硝酸中
无明显现象
浓硝酸具有强氧化性,常温下,铝表面被浓硝酸氧化为致密的氧化铝薄膜
D
向浓度均为0.1mol·L-1的KCl、KI的混合液中逐滴滴加稀AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A. A B. B C. C D. D
难度: 简单查看答案及解析
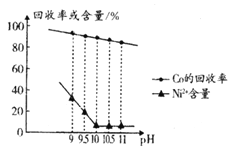


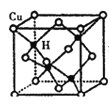
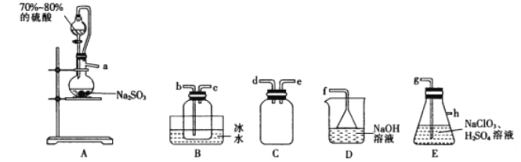


 。
。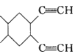 的合成路线:__________(其他试剂任选)。
的合成路线:__________(其他试剂任选)。