-
钛号称“崛起的第三金属”,因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
A. 上述钛原子中,中子数不可能为22
B. 钛元素在周期表中处于第四周期ⅡB族
C. 钛原子的外围电子排布为3d24s2
D. 钛元素位于元素周期表的d区,是过渡元素
难度: 简单查看答案及解析
-
下列元素一定是主族元素的是( )
A. 原子核外N电子层上只有一个电子的元素
B. 原子核外M层电子数为偶数的元素
C. 原子核外M层电子数为小于或等于7的奇数的元素
D. 原子核外N层电子数为2的元素
难度: 中等查看答案及解析
-
以下能级符号错误的是 ( )
A. 5p B. 7s C. 2f D. 4d
难度: 简单查看答案及解析
-
下列各能层中不包含d能级的是 ( )
A. M B. O C. L D. N
难度: 简单查看答案及解析
-
下列能级中轨道数为5的是 ( )
A. p能级 B. d能级 C. s能级 D. f能级
难度: 简单查看答案及解析
-
下列有关电子云的叙述中,正确的是 ( )
A. 电子云是电子绕核运动形成了一团带负电荷的云雾
B. 电子云直观地表示了核外电子的数目
C. 电子云形象地表示了电子在核外某处单位体积内出现的概率
D. 1s电子云轮廓图是球形,表示在这个球面以外,电子出现的概率为零
难度: 中等查看答案及解析
-
下列说法中正确的是 ( )
A. 同一原子中,1s、2s、3s电子的能量逐渐减小
B. 2s2表示2s能级有两个轨道
C. 同一原子中,2p、3p、4p能级的轨道数依次增多
D. 1s22s22p43s2表示的是激发态原子的电子排布式
难度: 中等查看答案及解析
-
下列氧原子的电子排布图中,正确的是 ( )
A.
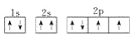
B.

C.

D.

难度: 简单查看答案及解析
-
下列元素周期表族序数正确的是 ( )
A. 第6列为ⅥA B. 第18列为0A
C. 第3列为ⅢB D. 第8列为ⅧB
难度: 中等查看答案及解析
-
下列说法中正确的是 ( )
A. s区、d区、ds区都是金属元素 B. s区都是主族元素
C. 稀有气体元素在ds区 D. 所有非金属元素都在p区
难度: 中等查看答案及解析
-
元素X的各级电离能数据如下:
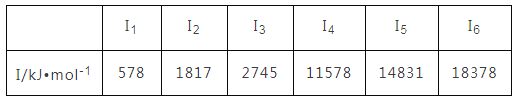
则元素X的常见价态是( )
A. +1 B. +2 C. +3 D. +6
难度: 简单查看答案及解析
-
元素的性质呈现周期性变化的根本原因是 ( )
A. 原子半径呈周期性变化 B. 元素的化合价呈周期性变化
C. 第一电离能呈周期性变化 D. 元素原子的核外电子排布呈周期性变化
难度: 简单查看答案及解析
-
下列各项说法中正确的是( )
A. π键是由两个p电子以“头碰头”方式重叠而成
B. π键比σ键重叠程度大,形成的共价键强
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,2个π键
难度: 中等查看答案及解析
-
下列物质的分子中既有σ键又有π键的 ( )
A. HCl B. CH4 C. C2H4 D. C2H6
难度: 中等查看答案及解析
-
从键长的角度来判断下列共价键中最稳定的是 ( )
A. H—F B. N—H C. C—H D. S—H
难度: 中等查看答案及解析
-
下列分子和离子中中心原子VSEPR模型为四面体且分子或离子空间的构型为V形的是 ( )
A. OF2 B. NH3 C. BF3 D. SO42-
难度: 中等查看答案及解析
-
用杂化轨道理论解释甲烷分子的正四面体结构,下列说法不正确的是 ( )
A. C原子的四个杂化轨道的能量一样
B. C原子有1个sp3杂化轨道由孤电子对占据
C. C原子的4个价电子分别占据4个sp3杂化轨道
D. C原子的sp3杂化轨道之间夹角一样
难度: 中等查看答案及解析
-
下列实验事实不能用氢键来解释的是( )
A. 冰的密度比水小,能浮在水面上
B. 接近沸点的水蒸气的相对分子质量测量值大于18
C. 水加热到很高的温度都难以分解
D. 邻羟基苯甲醛的沸点低于对羟基苯甲醛
难度: 中等查看答案及解析
-
离子键、共价键和分子间作用力是微粒之间的不同作用力。下列物质中只含有上述一种作用力的是( )
A. 氧化钠 B. 氯气 C. 氯化铵 D. 冰
难度: 中等查看答案及解析
-
碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为 ( )
A. CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大
B. CCl4与I2都是直线型分子,而H2O不是直线型分子
C. CCl4和I2都不含氢元素,而H2O中含有氢元素
D. CCl4和I2都是非极性分子,而H2O是极性分子
难度: 中等查看答案及解析
-
根据等电子原理判断,下列说法中错误的是( )
A. H3O+和NH3是等电子体,均为三角锥形
B. B3N3H6分子中存在双键,可发生加成反应
C. B3N3H6分子中所有原子均在同一平面上
D. CH4和NH4+是等电子体,均为正四面体
难度: 中等查看答案及解析
-
某基态原子的第四能层只有2个电子,则该原子第三能层中的电子数肯定为
A. 8个 B. 18个 C. 8~18个 D. 8~32个
难度: 中等查看答案及解析
-
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是 ( )
A. 根据对角线规则,推出Be(OH)2是一种两性氢氧化物
B. 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C. 根据同主族元素的电负性变化趋势,推出S的电负性比O大
D. 根据同周期元素的第一电离能变化趋势,推出O的第一电离能比N大
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法,不正确的是( )
A. NH5中既有离子键又有共价键
B. 1mol NH5中含有5mol N—H键
C. NH5的熔沸点高于NH3
D. NH5固体投入少量水中,可产生两种气体
难度: 困难查看答案及解析
-
把0.1mol氯化钴(III)(CoCl3·6NH3)溶于水,加入过量的硝酸银溶液,有0.3mol氯化银沉淀析出,此样品的配离子的表示式为( )
A. [Co(NH3)6]3+ B. [Co(NH3)5Cl]2+
C. [Co(NH3)4Cl2]+ D. [Co(NH3)3Cl3]
难度: 中等查看答案及解析