-
化学与生产、生活密切联系。下列说法正确的是
A. 陕西半坡出土的人鱼纹彩陶盆,其主要成分是二氧化硅
B. 高速公路护栏板采用碳素结构钢冷弯成型,表面常采用热浸镀锌保护,若镀层少量损坏仍可起保护作用
C. 长期盛放食用油最好应采用塑料瓶
D. 《天工开物》曰“凡墨烧烟凝质而为之”,其中“烟”指的是石墨
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,22.4 L C2H6O含有的O-H键数目为NA
B. 100 g 质量分数17%H2O2溶液中极性键数目为NA
C. 65 g Zn与足量浓硫酸充分反应得混合气体的分子数为NA
D. 1 L 0.1 mol/L K2Cr2O7溶液中含铬的离子总数为0.2NA
难度: 困难查看答案及解析
-
下列关于有机物的说法正确的是
A. 丙烯加聚后的产物可用于制造汽车保险杠
B. 蛋白质溶液里加BaCl2溶液可将蛋白质提纯
C. 乙酸乙酯和乙烯在一定条件下都能与水反应,且反应类型相同
D. 篮烷(
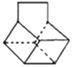 )的一溴取代物共有6种(不含立体异构)
)的一溴取代物共有6种(不含立体异构)难度: 中等查看答案及解析
-
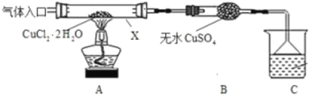
下列有关实验的叙述正确的是
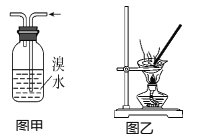
A. 向KI溶液中加入淀粉,然后滴入少量稀硫酸,开始无明显现象,片刻后溶液变蓝,则证明氧化性:H2SO4>I2
B. 图甲用于除去乙烯中的SO2
C. 用图乙装置蒸干明矾溶液制KAl(SO4)2·12H2O晶体
D. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
难度: 中等查看答案及解析
-
W、X、Y、Z为四种短周期主族元素且只有一种是金属元素。它们在元素周期表中的相对位置如下图所示。下列说法正确的是
A. X、Y、Z中Y单质与氢气化合最容易
B. W的氢化物具有较强的还原性
C. 元素Y和Z在自然界中均存在游离态
D. 氢化物的沸点X一定小于Y
难度: 中等查看答案及解析
-
科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如左图,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,并利用某CH4燃料电池(右图)作为电源。有关说法不正确的是
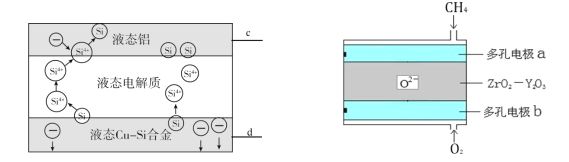
A. 电极c与a相连,d与b相连
B. 左侧电解槽中:Si 优先于Cu被还原,Cu优先于Si被氧化
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 相同时间下,通入CH4、O2的体积不同,会影响硅提纯速率
难度: 困难查看答案及解析
-
已知NaCN溶液中CN-水解常数
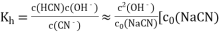 是NaCN溶液的起始浓度]。25℃时,向c0的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH-=-lg c(OH-)]的关系如图。
是NaCN溶液的起始浓度]。25℃时,向c0的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH-=-lg c(OH-)]的关系如图。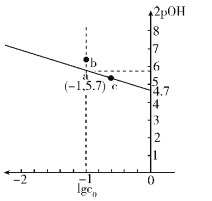
下列说法不正确的是
A. 其它条件不变,降低温度,可使b点变到a点
B. 相同温度时,c点对应溶液中的pH大于a点
C. 由图可知,25 ℃时,Kh(CN-)≈10-4.7
D. 向1 L lgc0=0的NaCN溶液中通入0.5 mol HCl气体,所得溶液中c(CN-)<c(HCN)
难度: 困难查看答案及解析