-
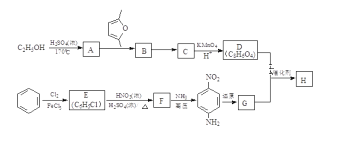
索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体步骤如下:
①包装: 取滤纸制成滤纸筒,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作a; 在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X 中冷却至室温,然后放入称量瓶中称量,质量记作b。
②萃取: 将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水,加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h)。
③称量: 萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发,待无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X 中冷却至室温,然后放入称量瓶中称量,质量记作c。
回答下列问题:
(1)实验中三次使用的仪器X 的名称为__________________。为提高乙
醚蒸气的冷凝效果,索氏提取器可选用下列_______(填字母) 代。
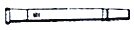


a 空气冷凝管 b 直形冷凝管 c 蛇形冷凝管
(2) 实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风
等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入
的药品为_______(填字母)。

a 活性炭 b 碱石灰 c P2O5 d 浓硫酸
无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是_______________________。
(3) 实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是_______。当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提筒中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶) 的物理现象为_______。索氏提取法与一般萃取法相比较,其优点为___________________________。
(4) 数据处理: 样品中纯脂肪百分含量_________(填“<”、“>”或“=”) (b-c)/(b-a)×100%;测定中的样品、装置、乙醚都需要进行脱水处理,否则导致测定结果__________(填“偏高”、“偏低”或“无影响”)。
-
含氮化合物在材料方面的应用越来越广泛。
(1) 甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+ NH3(g)  CH3NH2(g)+H2O(g) △H
CH3NH2(g)+H2O(g) △H
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
| 化学键 | C-H | C-O | H-O | N-H | C-N |
| 键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
| NH3(g)/mol | CH3OH(g)/mol | 反应条件 |
| 甲 | 1 | 1 | 498K,恒容 |
| 乙 | 1 | 1 | 598K,恒容 |
| 丙 | 1 | 1 | 598K,恒压 |
| 丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2) 工业上利用镓(Ga) 与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理 为2Ga(s)+2NH3(g) 2GaN(s)+3H2(g) △H=-30.81kJ·mol-1。
2GaN(s)+3H2(g) △H=-30.81kJ·mol-1。
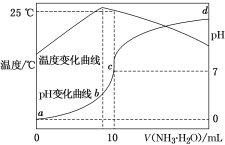
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。
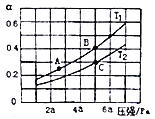
a.纵轴a表示NH3的转化率b.纵轴a 表示NH3的体积分数c.T1<T2d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA 族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
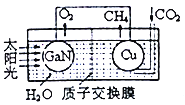
(3) 用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________ (填“盐酸”或“硫酸”)。
-
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJ•mol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJ•mol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
①该反应逆反应速率表达式为:v逆=k•c(CO) •c3(H2),k 为速率常数,在某温度下测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.05 | c1 | 4.8 |
| c2 | c1 | 19.2 |
| c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3•mol-3•min-1。
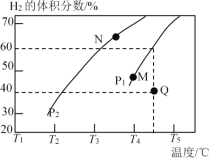
②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
-
铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态K原子核外电子排布简写式为___________。 K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是_________,各元素的第一电离能由大到小的顺序为_________。
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_______。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为_________。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于_____晶体。
(4)右图是金属单质常见的两种堆积方式的晶胞模型。
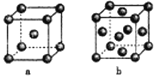
①铁采纳的是a堆积方式.铁原子的配位数为_____,该晶体中原子总体积占晶体体积的比值为____(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为_____g·cm-3(用含有r、NA的最简代数式表示)。
Na2S+2CO2↑。下列有关说法正确的是( )
 D. 非金属性:X>Y
D. 非金属性:X>Y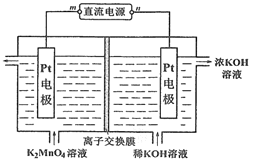
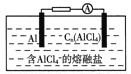
4Al2Cl7-+3Cn(Cn表示石墨)。下列说法正确的是( )







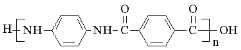 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: