-
下列关于浓硫酸的叙述中,正确的是( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等
D. 浓硫酸在常温下能够使铁、铝等金属形成致密的氧化膜而钝化
难度: 困难查看答案及解析
-
下列表述正确的是( )
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由涂加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A. ①②③ B. ②④ C. ③④⑤ D. ③⑤
难度: 中等查看答案及解析
-
在一定条件下,下列物质不能和二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤氢氧化钾 ⑥氧化钙 ⑦氮气
A. ③⑤⑦⑧ B. ③⑦ C. ①④⑦ D. ⑦
难度: 简单查看答案及解析
-
区别SO2与CO2可用的方法是( )
A. 品红溶液 B. 澄清石灰水 C. 紫色石蕊试液 D. BaCl2溶液
难度: 简单查看答案及解析
-
下列化合物不能由单质之间直接化合得到的是( )
A. FeS B. H2S C. SO3 D. FeCl3
难度: 简单查看答案及解析
-
下列溶液可以盛放在玻璃试剂瓶中,但不能用磨口玻璃塞的是( )
A. 氨水溶液 B. 氢氟酸 C. 氢氧化钠溶液 D. 氯化钠溶液
难度: 简单查看答案及解析
-
下列有关硅及硅的化合物的性质、用途说法错误的是( )
A. 二氧化硅作光导纤维材料
B. 硅酸钠溶液可以做木材防火剂
C. 太阳能电池可采用硅材料制作,其应用有利于环保、节能
D. 高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸的酸性比碳酸强
难度: 简单查看答案及解析
-
通常情况下,下列操作不能区别浓硫酸、稀硫酸的是( )
A. 分别加入铁片 B. 分别加入蔗糖
C. 分别滴在纸上 D. 分别加入BaCl2溶液
难度: 中等查看答案及解析
-
在检验溶液中SO42-的过程中,下列操作中正确的是( )
A. 先加入稀硝酸,无沉淀产生,然后再加硝酸钡溶液,产生白色沉淀,证明有SO42-存在
B. 先加入硝酸钡溶液,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在
C. 先加入稀盐酸,无产生沉淀,然后再加氯化钡溶液,产生白色沉淀,证明有SO42-存在
D. 先加入氯化钡溶液,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
难度: 中等查看答案及解析
-
工业上采用接触法制硫酸,其中在接触室进行的反应是( )
A. S+O2
SO2 B. 4FeS2+11O2
2Fe2O3+8SO2
C. 2SO2+O2
2SO3 D. SO3 + H2O=H2SO4
难度: 简单查看答案及解析
-
在反应3S+6NaOH
2Na2S+Na2SO3+3H2O中被氧化的硫与被还原的硫的关系是( )
A. 物质的量之比为2∶1 B. 质量比为2∶1
C. 质量比为1∶2 D. 物质的量之比为1∶1
难度: 简单查看答案及解析
-
SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是( )
①酸性KMnO4溶液②溴水③碘水④氯水⑤FeCl3溶液
A. ①⑤ B. ②③ C. 全部 D. 都不是
难度: 困难查看答案及解析
-
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
L气体,则被还原的H2SO4的量是( )
A.
mol B.
mol C.
g D.
g
难度: 困难查看答案及解析
-
对于Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O反应,下列说法正确的是( )
A. Cu作还原剂,发生还原反应
B. 被还原的H2SO4与参加反应的H2SO4的物质的量比为1∶2
C. 当生成2.24 L(标准状况下)SO2时,转移的电子为2mol
D. 当Cu足量时,H2SO4可完全反应
难度: 困难查看答案及解析
-
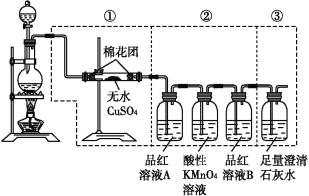
检验SO2中是否混有CO2气体,可采用的方法是( )
A. 通过品红溶液,若品红溶液褪色,则说明混有CO2气体
B. 通过澄清石灰水,若变混浊,则说明混有CO2气体
C. 先通过NaOH溶液,再通过澄清石灰水,若变混浊,则说明混有CO2气体
D. 先通过足量KMnO4溶液(具有强氧化性),再通过澄清石灰水,若变浑浊,则说明CO2气体
难度: 简单查看答案及解析
-
SO2和CO2在化学性质上既有相同点也有不同点。下列溶液:
①BaCl2溶液; ②H2S溶液; ③澄清石灰水;
④酸化的Ba(NO3)2溶液; ⑤品红溶液; ⑥Na2SiO3溶液;
⑦酸性KMnO4溶液; ⑧紫色石蕊溶液
不能用于鉴别SO2和CO2气体的是
A.①③⑥⑧ B.①③④⑥ C.②③⑥⑧ D.①④⑥⑧
难度: 中等查看答案及解析
-
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
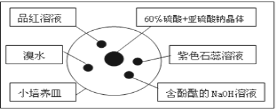
A. 紫色石蕊溶液先变红后褪色 B. 品红溶液褪色
C. 溴水橙色褪去 D. 含酚酞的NaOH溶液红色变浅
难度: 中等查看答案及解析
-
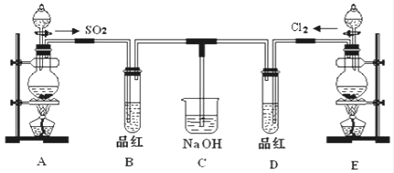
将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( )

A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
难度: 简单查看答案及解析
-
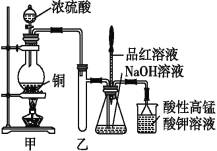
用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
难度: 中等查看答案及解析
-
下列各物质中,不能满足“
 ”转化关系的一组是
”转化关系的一组是X
Y
Z
A
Si
SiO2
Na2SiO3
B
Fe
FeCl3
FeCl2
C
HCl
Cl2
HClO
D
H2SO4
SO2
SO3
难度: 中等查看答案及解析
-
有一瓶久置的Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量样品溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀.对此实验下述结论正确的是( )
A. Na2SO3已部分被空气中的氧气氧化
B. 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C. 加硝酸后的不溶性沉淀中含有BaSO4
D. 此实验能确定Na2SO3是否部分被氧化
难度: 困难查看答案及解析
-
用20mL18.4mol·L-1的浓H2SO4与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液稀释到100mL,得到溶液中
的浓度为3.18mol·L-1,则此时溶液中CuSO4的物质的量浓度为
A. 0.50mol·L-1 B. 0.75mol·L-1 C. 1.00mol·L-1 D. 3.18mol·L-1
难度: 中等查看答案及解析