-
2018年5月第八次全国生态环境保护大会在北京召开,旨在保护环境、造福人类。下列说法不正确的是( )
A. “光化学烟雾”、“硝酸酸雨”的形成都与氮氧化物有关
B. 绿色化学的核心是应用化学原理对环境污染进行治理
C. 用光催化分解代替电解水制备氢气,可实现节能环保
D. 用可降解塑料聚乳酸代替聚乙烯塑料可减少白色污染
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 纤维素、花生油、蚕丝在一定条件下都能发生水解反应
B. 煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
C. 新戊烷用系统命名法命名为2,2-二甲基戊烷
D. 正四面体烷(
)与立方烷(
)的二氯代物数目相同
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 1mol-OH中含有的电子数为10NA
B. 标准状况下,22.4LSO3中含有的氧原子数目为3 NA
C. 14g乙烯和丙烯的混合物中极性键数目为2 NA
D. 一定条件下将1molN2和3molH2混合,充分反应后所得NH3的分子数为2 NA
难度: 中等查看答案及解析
-
用下图所示实验装置进行相应实验,能达到实验目的的是( )
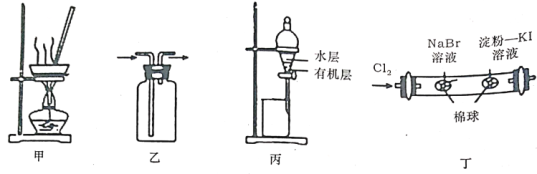
A. 用图甲所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体
B. 按装置乙所示的气流方向可用于收集H2、NO等
C. 用图丙所示装置,分离CCl4萃取碘水后的有机层和水层
D. 用图丁所示装置,可以证明氧化性:Cl2>Br2>I2
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数逐渐增大,W原子的核外电子总数与X原子次外层的电子数相同。X和Y的简单阳离子的电子层结构相同,Z的一种含氧酸具有杀菌消毒和漂白作用。Y单质可以用于野外焊接钢轨。下列说法正确的是( )
A. 简单离子半径:X>Y>Z
B. 最高价氧化物对应水化物的碱性:X>Y
C. W、Z的简单氢化物的沸点:W<Z
D. Z与X、Y两种元素都能形成二元离子化合物
难度: 中等查看答案及解析
-
最近我国科学家在液流电池研究方面取得新进展。一种硫/碘体系(KI/K2S2)的液流电池工作原理如图所示。下列说法正确的是( )
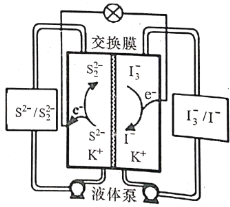
A. 放电时电池右侧为负极,发生氧化反应
B. 放电时电池左侧的电极反应为S22-+2e-==2S2-
C. 充电时电解质溶液中K经交换膜向右侧移动
D. 充电时电池的总反应为3I-+S22-=I3-+2S2-
难度: 中等查看答案及解析
-
常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
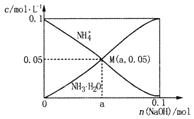
A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,
不断增大
D. 当n(NaOH)=0.05mo1时,溶液中有:c(Cl-)> c(NH4+)>c(Na+)>c(OH-)>c(H+)
难度: 困难查看答案及解析
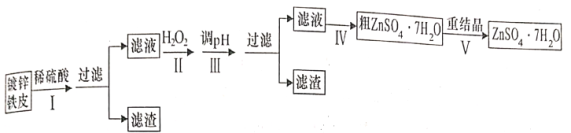
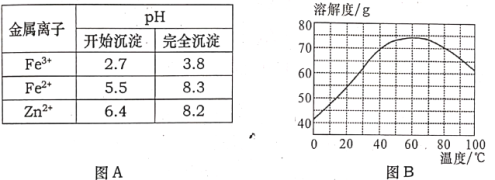
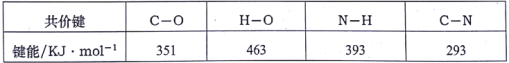
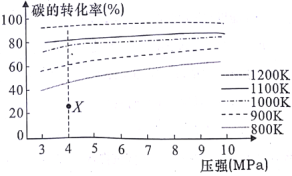
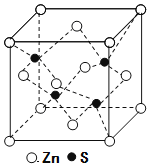
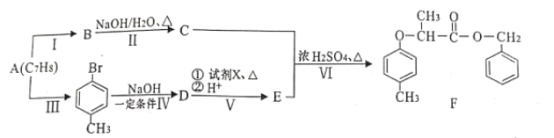
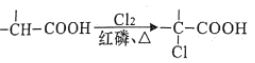
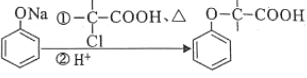
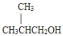 为原料制取试剂X
为原料制取试剂X CH3CH2OH
CH3CH2OH